在医疗机构对营养不良(即营养不足)患者采取营养支持疗法有助于改善机体的结构和功能,改善临床疗效,降低并发症的发生率和死亡率。临床营养支持治疗的方式有三种,即口服营养补充剂(oral nutritional supplements,ONS)、肠内营养(enteral nutrition,EN)和肠外营养(PN)。
当胃肠功能严重障碍时,机体能量需求常以TPN 供给,或当 EN 供给不足(<总能量需求60%)时,也常联合部分肠外营养(partial parenteralnutrition,PPN)支持治疗。
肠外营养的适应症和禁忌症
凡需要营养支持,但又不能或不宜接受EN 的患者均为 PN 的适应证。此外,临床上许多患者虽然能够接受 EN,但由于疾病等原因,无法通过 EN 满足机体的能量和蛋白质目标需要量,需要补充或联合 PN。2012 年 ASPEN 更新了应用 TPN 的准则,按疗效显著程度分为疗效显著的强适应证、对治疗有益的中适应证、疗效不确定的弱适应证和禁忌证。
肠外营养适应症
总适应症
a. 长时间(>7 天)不能通过进食或经肠内途径摄入每日所需热量、蛋白质或其他营养素者;
b. 由于严重胃肠道功能障碍或不能耐受 EN 而需营养支持者;
c. 通过EN 无法达到机体需要的目标量时应该补充 PN。
具体适应症:
a. 由于以下情况无法进食或通过消化道吸收营养物质:广泛小肠切除、小肠疾病、放射性肠炎、严重腹泻、顽固性呕吐等;
b. 接受大剂量放、化疗的营养不良患者;
c. 进行骨髓移植患者;
d. 无法进行或不能耐受 EN 的重症胰腺炎患者;
e. 消化道功能障碍的严重营养不良患者;
f. 营养不良的获得性免疫缺陷性疾病患者或存在并发症(如顽固性腹泻、并发其他感染、接受化疗等)的获得性免疫缺陷性疾病患者;
g. 严重分解代谢状态下患者(如颅脑外伤、严重创伤、严重烧伤等),在 5~7 天内无法利用其胃肠道的。
肠外营养禁忌症
虽然PN 在某种程度上具有不可替代的意义,但某些情况下并不适宜或应慎用 PN:
a. 胃肠道功能正常,能获得足量营养的;
b. 估计需 PN 支持少于 5 天的;
c. 心血管功能紊乱或严重代谢紊乱尚未控制或纠正期;
d. 预计发生 PN 并发症的风险大于其可能带来的益处的;
e. 需急诊手术者,术前不宜强求 PN;
f. 临终或不可逆昏迷患者。
肠外营养配方
TPN 的营养物质必须完整,包括水、碳水化合物、氨基酸、脂肪、电解质、维生素和微量元素。特殊情况下,也可加入某些特殊营养物质(如药理营养素),其独特的药理作用可能影响预后。
(1)能量摄入
确定适当的能量摄入,避免摄入过度或不足是十分必要的。间接测热法可提供机体能量消耗最准确的数据,但不易获得,临床常采用一些公式估算患者的总能量消耗(total energy expenditure,TEE),以指导制定热量目标。
a. 拇指法则,即成人每日热量目标约为25~30kcal/kg。
肥胖患者采用校正体重,透析患者采用干体重。
校正体重= 理想体重 +[0.4×(实际体重 - 理想体重)]
理想体重(idea bodyweight,IBW)有多种计算方式,国外推荐男性使用Devine 公式,女性使用 Robinson 公式:
男性:IBW = 50 +2.3×(身高cm/2.54 - 60)
女性:IBW = 48.67 +1.65×(身高cm/2.54 - 60)
也可使用简易公式:
男性:IBW = 身高cm - 105
女性:IBW = 身高cm - 100
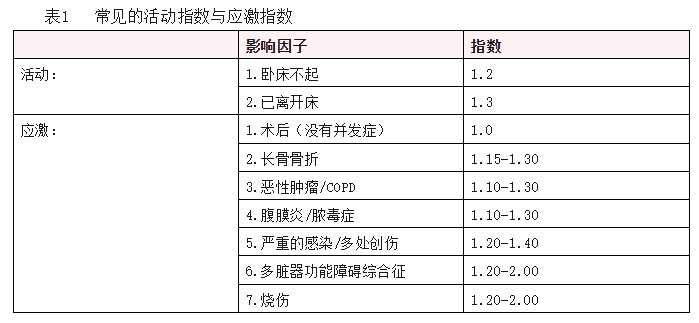
b. 用Harris-Benedict(H-B)公式估算静息状态下的基础能量消耗(basal energy expenditure,BEE),TEE = BEE×活动指数×应激指数,见表1。
BEE(Harris-Benedict公式):
男性:BEE(kcal/d)= 66.47+(13.75×实际体重,kg)+(5.0×身高,cm)-(6.76×年龄,岁)
女性:BEE(kcal/d)= 655.1+(9.56×实际体重,kg)+(1.85×身高,cm)-(4.67×年龄,岁)
(2)氨基酸供给
氨基酸的供给量应根据患者体重和临床情况而定,健康成人的氨基酸需要量是0.8~1 g/kg。机体的蛋白质更新是一个持续动态变化的过程,其合成和分解速率受饥饿、应激、营养不良及其他急慢性疾病状态的影响,胰岛素和儿茶酚胺水平也起着重要的调节作用。
在严重分解代谢、明显的蛋白质丢失或重度营养不良时需要较大剂量,而肝肾功能不全的患者则需限制氨基酸用量甚至调整氨基酸组成(如肝性脑病患者选用高支链氨基酸配方,肾功能不全患者选用必需氨基酸配方)。
充足的非蛋白热量(nonprotein caloric,NPC,即 TNA 中葡萄糖与脂肪所提供的能量,1 g 葡萄糖可提供约 3.4kcal 能量、1 g 脂肪可提供约 9kcal 能量)对蛋白质的有效利用十分重要。大多数稳定的患者需150kcal NPC:1 g 氮,其中含氮量可由公式「含氮量,g = 氨基酸含量,g/6.25」计算获得。1 g 氨基酸可提供约 4kcal 热量。
(3)非蛋白热量供给
葡萄糖和脂肪是TNA 中最主要的两种能量底物,70%~85% 的葡萄糖与 15%~30% 的脂肪是健康成人 NPC 供能的最佳比例,可根据患者的耐受情况调整糖脂比,脂肪占比一般不超过60%。此外,也可根据患者体重估算 NPC 供给,一般推荐成人每日葡萄糖供给量<7 g/kg、脂肪供给量<2.5 g/kg。
某些疾病,如呼吸衰竭患者可增加脂肪供给以维持正常的呼吸熵、非手术肿瘤患者可增加脂肪供给以适应机体代谢的改变。在严重疾病时,需考虑胰岛素抵抗或脂肪利用障碍而灵活调整糖脂比。伴有明显高甘油三酯血症患者应限制脂肪的供给量,用胰岛素来保证血糖浓度正常。
(4)液体量
液体量应根据患者每日情况计算提供。综合评估患者心脏、肾脏功能,密切关注体重变化、出入量平衡(包括经口或经静脉补充的液体和尿量、其他途径液体丢失等情况)、监护患者是否存在脱水、水肿或腔内液体积聚。
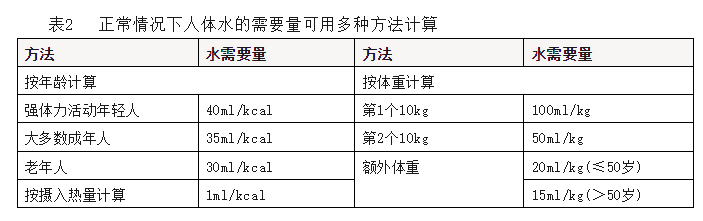
高热量摄入、妊娠、发热、大量出汗、腹泻、烧伤、外科引流等情况下,机体对水的需要量增加;心、肾功能不全时,常需限制液体供给。
(5)电解质
电解质平衡的管理需动态监测患者的症状体征、液体出入量及血电解质指标(即血钠、血钾、血钙、血镁、血磷等)。在低蛋白血症时,若血钙低于正常值,则血中蛋白结合钙降低,而离子钙不低,不发生临床症状,此时血钙指标需要校正,「校正钙浓度,mg/dL = 血钙浓度,mg/dL + 0.8×(4.0 - 血白蛋白浓度,g/dL)」。
此外,血清镁浓度与机体镁缺乏不一定平行,TPN 中应常规补充。
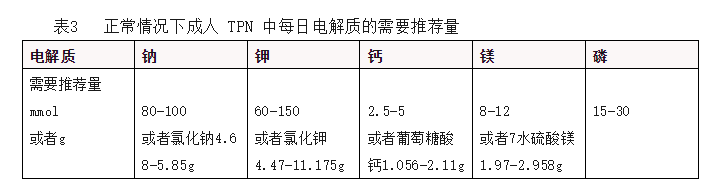
然而,其实际需要量应根据临床情况进行调整,如胃肠道丢失时应增加,肾衰竭或血电解质水平偏高时应减少。
(6)微量营养素
维生素和微量元素已有基本需要量的复合制剂。但在某些特殊患者(如危重患者、烧伤患者或伴有肠瘘等情况时),某些微量营养素的组分可能不足,需要额外剂量或单一制剂的添加。然而,给予的剂量必须适应患者的排泄能力。
(7)药理营养素
营养方案可通过添加药理营养素(如ω-3脂肪酸、谷氨酰胺)进一步完善。研究发现,ω-3 脂肪酸 0.2g/kg 用于术后患者、0.3~0.6 g/kg 丙氨酰谷氨酰胺二肽制剂用于危重患者可能改善预后。需注意,在加入这些物质后,一些常规的常量营养素应相应减少,以满足常规标准营养液中三大营养物质的供能比例。
肠外营养的输注系统
肠外营养的规范化应用提倡“全合一系统”(All-in-One,AIO,也称TNA)。其中,自配型肠外营养主要用于病情特殊或多变的、需要营养干预的患者,多腔袋(multi-chamber bag,MCB)主要用于病情稳定的营养不良或高风险患者。
肠外营养的输注途径
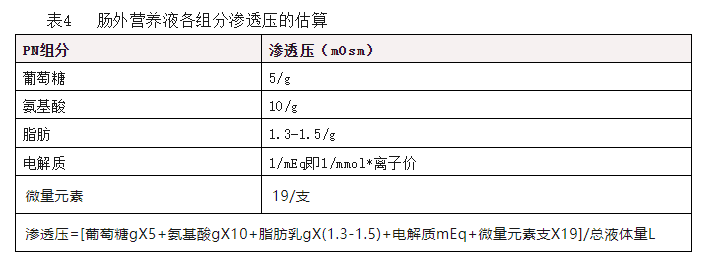
通过外周静脉置管(peripheral venous catheter,PVC)给予肠外营养是首选的输注途径,具有静脉入路容易、护理方便、不存在中心静脉置管风险和较为经济等优点。但高渗营养液易引起血栓性静脉炎,PN 超过 14 天者,通常应行中心静脉置管(central venous catheter,CVC)。外周肠外营养适用于接受较低渗透浓度(通常建议≤ 900mOsm/L)营养液的短期治疗。PN 中各组分的总渗透压除以总液体量即为渗透浓度。
肠外营养液持续静脉滴注时的最少输注时间必须适应葡萄糖的最大氧化速率(一般为4~5 mg/kg/min,危重患者为3~4 mg/kg/min)。外周肠外营养时,输注时间越长,血栓性静脉炎的发生率越高。
肠外营养的并发症及防治原则
PN 的并发症主要分为与输注途径有关的导管相关并发症和与输液成分有关的代谢性并发症。
(1)导管相关并发症
导管相关并发症常发生在中心静脉置管过程中,也有少数是长期应用、导管护理不当或拔管操作所致,受通路种类、操作经验、治疗持续时间、管路护理质量和患者的基础疾病状态等因素影响。分为机械性并发症、感染并发症和血栓栓塞并发症。
机械性并发症常发生在中心静脉置管的穿刺过程中,不同穿刺部位并发症种类和发生率不尽相同。穿刺前纠正患者的凝血功能异常,选择合适体位,采用超声静脉定位,穿刺时先用细针头定位,插管时采用「J」形头导丝引导技术等,有助于减少并发症的发生。
中心静脉导管相关感染是PN 时最常见、最严重的并发症,包括全身感染和局部感染。全身感染是导管所致菌血症或脓毒血症,患者可出现寒战、高热、呼吸急促、低血压等,严重者可出现意识模糊。实验室检查见血中白细胞、中性粒细胞等感染指标升高。如果临床上表现为菌血症但无明显感染部位时,应怀疑导管相关感染的存在。
局部感染是发生在导管局部皮肤或周围组织的感染、腔隙感染或隧道感染。预防导管相关感染最重要的措施是在穿刺置管、PN 配置、给药和导管护理时严格遵守无菌原则,一般不需预防使用抗菌药物,没有感染证据时也不必定期更换导管。明确发生导管相关感染的患者必须拔除导管,并送导管尖端、导管出口渗液和经导管抽出的血样做培养。
多数情况下,拔管后患者症状很快好转,不需使用抗菌药物。若患者症状持续且感染指标呈上升趋势,则需开始抗感染治疗。抗菌药物的选择应针对可能的致病微生物及当地的病原菌耐药情况,随后根据细菌培养及药敏结果指导调整。
当患者无感染症状而怀疑导管相关感染时,可暂不拔管,但应停止输液,经导管抽取血样送细菌培养,并用高浓度抗菌药物封管,根据细菌培养结果决定是否继续保留和使用导管。
随着PN 时间延长,导管相关的静脉血栓形成发生率逐渐增高。导管相关的静脉血栓形成常见于锁骨下静脉和上肢静脉,血栓形成后可逐渐增大并脱落,造成血栓栓塞,严重血栓栓塞可导致患者死亡。抗凝治疗可减少导管相关静脉血栓形成的发生率和血栓栓塞的风险,低分子肝素和华法林均有预防作用,但 PN 中加入无效。
已有血栓形成的患者可进行溶栓治疗。导管阻塞常因导管内血栓形成或药物、无机盐沉淀所致,PICC 通路的发生率高于其他中心静脉通路。可试用溶栓药冲洗,必要时更换导管。
(2)代谢性并发症
肠外营养中各组分供给不足或过量,均会引起代谢性问题,见表5。在临床实践中,准确评估每位患者的营养素需求是非常困难的,因此,必须积极营养监测,根据患者的代谢需求调整营养方案。
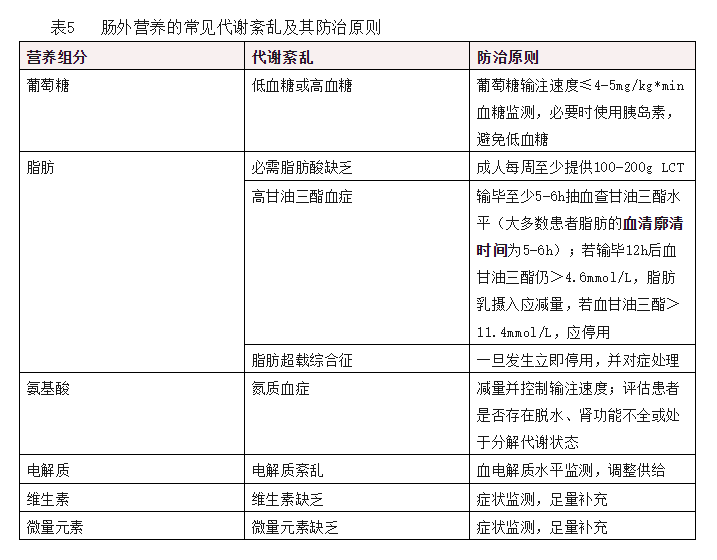
机体营养物质代谢紊乱可能导致一些临床急症或进一步发展为脏器功能损害。
a. 脂肪超载综合征是由于脂肪乳剂输注速度和(或)剂量超过机体的脂肪廓清能力,导致的以血甘油三酯(triacylglycerol,TG)升高为特征的症候群。发病机制涉及脂肪乳的性质、用量和患者的功能状态,包括氧化应激、炎症反应、免疫应答、植物固醇、脂肪廓清、脂质体、血小板、内皮细胞等。
临床表现为肝脾肿大、黄疸、低蛋白血症、发热、急性呼吸窘迫综合征、代谢性酸中毒、血小板减少、出血、弥散性血管内凝血等。防治的关键是了解不同来源脂肪乳剂的特性,避免过量、过速使用,评估患者的脂肪廓清能力,密切监测血TG 水平,一旦发生立即停用,并对症处理。
b. 严重营养不良患者体内磷含量常减少,开始营养支持后,特别是过快过量摄入能量底物后,ATP 合成增加可能导致血磷浓度迅速降低,磷补充不足时更易发生,称为「再喂养综合征」。除低磷血症外,还可合并低镁血症、低钾血症、维生素缺乏、液体潴留。
临床可表现为危及生命的心律失常,神经精神改变(如谵妄、癫痫发作等),严重低磷引起呼吸肌无力、通气不足甚至呼吸衰竭。如不能及时诊断和处理,并发症的发生率和死亡率较高。防治再喂养综合征的第一步是识别高危患者,危险因素主要包括:营养不良的严重程度、过快的营养支持、未及时补充电解质和维生素或合并致电解质和维生素吸收不良的疾病等。
在PN 开始前,尽量纠正电解质缺乏,特别是钾、镁、磷,补充维生素 B1,能量摄入应从目标量的 50% 开始,逐步加量。
c. 肠外营养相关肝脏疾病(parenteral nutrition-associated liver disease,PNALD)是长期 TPN 的常见并发症,包括肝脏脂肪变性和肝脏胆汁淤积等。肝脏脂肪变性表现为血转氨酶升高(超过正常上限 1.5 倍)、血胆红素轻度升高和肝脏增大(超声提示回声增强),目前认为主要由于过度喂养特别是葡萄糖过量引起。
过量的葡萄糖进入体内后不能被完全利用,转化为脂肪沉积于肝内,引起脂肪肝,尤其易发生于原有肝脏疾病或其他伴发疾病(如脓毒血症、中重度营养不良、短肠综合征、因放化疗肠道损伤)的患者。早期的肝脏脂肪变性是可逆的,发生在门脉周围,但可进展为整个小叶的脂肪性肝炎,伴有不同程度的胆汁淤积和纤维化。
可能发展为肝硬化和肝衰竭,是肠外营养最严重的并发症之一,在新生儿和儿童常见,应尽可能预防或减少其发生。对于长期TPN 且已有肝酶升高的患者,可选择周期性输注(每次间隔 6~8 h)以减少脂肪变性的发生。尽早刺激肠道(EN 供给),预防细菌过度生长,口服熊去氧胆酸逆转严重胆汁淤积,选择合适的脂肪乳剂,提供适宜的氨基酸和牛磺酸。
d. 长期TPN 时肠道处于休息状态,肠道激素的分泌受抑制,胆囊运动减少,胆汁成分改变,导致胆囊淤积和胆囊扩张,进一步可发展为胆石症和胆囊炎。给予胆囊收缩素,或少量 EN 供给可刺激胆囊收缩,防治胆囊淤积。
e. 长期TPN 可能破坏肠粘膜的正常结构,肠粘膜上皮萎缩、变稀,皱褶变平,肠壁变薄,肠通透性改变,肠屏障功能减退,肠道细菌移位引起肠源性感染。应尽早改用 EN,补充谷氨酰胺。
f. 长期TPN 治疗的儿童易患佝偻病,原因是 TPN 中提供的钙、磷远不能满足儿童的生长发育需求,必须额外补充。长期 TPN 治疗的成年患者活动减少、性激素分泌减少、类固醇治疗及长期肠道衰竭致钙、磷、镁缺乏和维生素 D 缺乏或过量,危害骨骼代谢,常有骨钙丢失、血碱性磷酸酶增加、高钙血症、骨痛甚至骨折。
目前还不明确如何预防这种并发症,但增加磷和镁的摄入、交替补充维生素D 和足量的钙以及运动可能有用。
肠外营养支持治疗过程中可能发生各种并发症,临床实践过程中必须密切监护,及时调整营养液配方,优化周期性营养方案。
参考文献:广东省药学会. 肠外营养临床药学共识(第二版).
素材来源为网络,如侵删