摘 要:
目的:分析我国特殊医学用途配方食品注册审批情况,为特殊医学用途配方食品的研发、申报提供参考。
方法:通过国家市场监督管理总局特殊食品信息查询平台查询2017~2022年批准产品情况,分析批准的产品类别、形态、适用人群等方面内容。
结果:我国特殊医学用途配方食品法规不断完善,注册产品不断增加。产类别方面,特殊医学用途婴儿配方食品数量最多;产品形态方面,粉状产品占比最大。
结论:我国特殊医 学用途配方食品法规仍需不断完善,企业开发特殊医学用途配方食品的数量和类别有待进一步提高和丰富。
关键词:特殊医学用途配方食品;注册
《特殊医学用途配方食品注册管理办法》中将 特殊医学用途配方食品(food for
special medical purpose,FSMP)定义为:为了满足进食受限、消化吸收障碍、代谢紊乱或特定疾病状态人群对营养素或膳食的特殊需要,专门加工配制而成的配方食品[1]。包括0月龄~12月龄特殊医学用途婴儿配方食品和适用于1岁以上人群的特殊医学用途配方食品[2-3] 。该类产品必须在医生或临床营养师指导下,单独食用或与其他食品配合食用[3]。特殊医学用途配方食品(以下简称特医食品)在我国最早以肠内营养制剂形式存在、流通与使用[4],其生产与进口主要按化学药品进行监管。目前根据我国国家标准体系构建,特医食品在我国归入特殊膳食用食品的范畴。2015年《中华人民共和国食品安全法》的颁布,赋予了特医食品的法律身份[5]。研究和临床
实践表明,特医食品在增强临床治疗效果、促进康 、缩短住院时间、改善患者生活质量方面具有重要的临床意义[6-7]。为科学有序管理特医食品,各国制定相应的法律法规。从全球范围来看,各国均以国际食品
法典委员会的标准作为依据,如CODEXS TAN 72.1981《婴儿配方及特殊医用婴儿配方食品标准》和CODEXS TAN 180.1991《特殊医用食品标 签和声称法典标准》,在此基础之上建立本国的法规。除日本需要特医食品上市前通过日本厚生省批准外,欧盟、美国、澳大利亚、新西兰的法规要求基本与国际法典一致,均不需要上市前的注册批准[5]。我国相对欧美等国的企业备案制开启了更严格的监管模式,实行上市前的产品注册审批制,相应的法规及配套文件也陆续出台,形成了较完整的特医食品注册管理体系。从2010~2019年, 先后发布了《食品安全国家标准特殊医学用途婴儿配方食品通则》(GB
25596-2010) [2]、《食品安全国家标准特殊医学用途配方食品通则》(GB 29922-2013) [3] 、《食品安全国家标准特殊医学 用途配方食品良好生产规范》(GB 29923-2013) [9] 、《中华人民共和国食品安全法》[5]、《特殊医学用途配方食品注册管理办法》[1]、《特殊医学用途配方食品临床试验质量管理规范(试行)》[10-17]等法规,从产品的技术要求、审评注册、临床试验等方面做了规范,为申请人明确了注册申请的方向、细化了申报资料的具体要求。上述法律、法规和指导原则等文件的相继出台,为我国特医食品的研发、生产和监管等提供了依据,为我国特医食品产业的发展奠定了良好的理论基础。
本文通过对2017~2022年8月23日申请和批准的特医食品情况进行统计分析,包括产品类别、产品形态、适用人群等方面内容,为特医食品的研发、申报、监管等提供参考。
1 资料与方法
1.1 数据来源
国家市场监督管理总局特殊食品信息查询平台,2017~2022年8月23日申请和批准的特医食品。
1.2 统计方法
采用Excel对包括年审批数量、产品类别、产品形态、适用人群等内容进行整理、汇总和统计分析。
2 结果与分析
2.1 批准上市产品总体情况
批准上市情况总体呈上升趋势,但波动明显。2017年获批产品数量最少,为3个,2021年获批产品数量达峰值,为24个。见图1。批准上市产品共计88个,包括67个粉状产品,21个液态产品。适用于12月龄及以下婴儿的产品38个,按批准注册产品分类包括:12个早产/低出生体重婴儿配方、11 个无乳糖配方/低乳糖配方、6个乳蛋白部分水解配方、4个乳蛋白深度水解/氨基酸配方、4个母乳营养补充剂,1个氨基酸代谢障碍配方;适用于1岁以上特医食品50个,包括:非全营养配方产品26个、全营养配方产品21个、氨基酸代谢障碍配方2个、特定全营养配方产品1个。
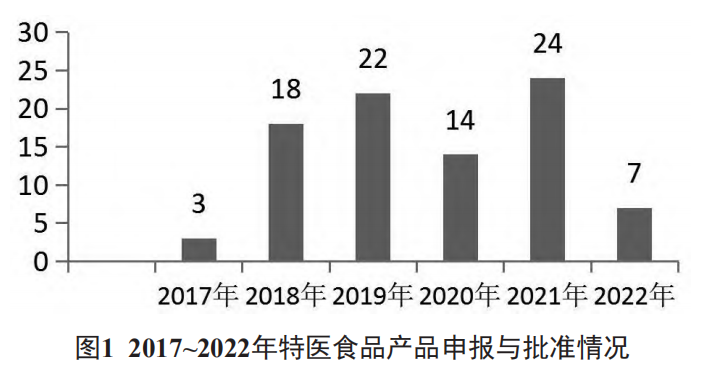
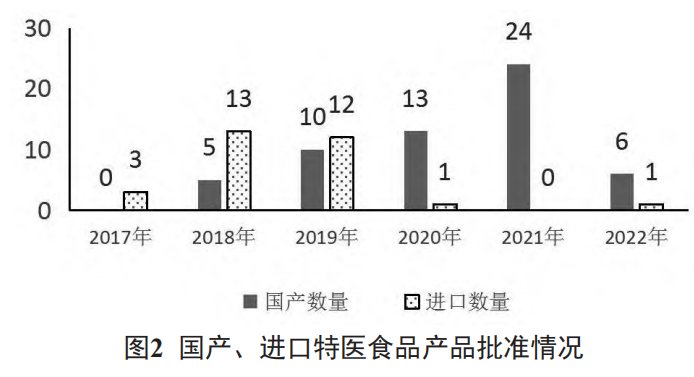
2.2 批准上市产品国产与进口分布情况
批准上市的产品中,国产58个,进口30个。国产品种方面,2017~2021年批准数量逐年递增,2022年截止当前批准数量为6个;进口品种方面,2017~2019年总体呈上升趋势,2019年后总体呈下降趋势。见图2。
2.3 批准上市产品形态分布
由批准的产品形态组成可见,粉状产品占比约为76.1 %,液态产品占比约为23.9 %。各产品类别分布情况如下:非全营养产品中,粉状产品占比约为34.6 %,液态产品占比约为65.4 %,其中电解质组件和碳水化合物组件的液态产品占比均达到80 %以上;特殊医学用途婴儿配方食品中粉状产品占比约95 %。
2.4 非全营养产品批准上市情况
非全营养配方产品的批准情况方面,电解质组件批准数量最多,为12个;其次是碳水化合物组件产品,为8个;蛋白质(氨基酸组件)批准数量最少,为5个。截至目前,流质配方、增稠组件均暂未批准。
2.5 特殊医学用途婴儿配方食品批准上市情况
特殊医学用途婴儿配方食品的批准情况方面,早产/低出生体重婴儿配方批准数量最多,为12个;其次是无乳糖/低乳糖配方产品,为11个;乳蛋白部分水解配方,为6个;乳蛋白深度水解配方/氨基酸配方和母乳营养补充剂,均为4个;氨基酸代谢障碍配方批准数量最少,为1个。总体上看,基本覆盖了GB 25596中特殊医学用途婴儿配方食品全部类别。
3 讨论与建议
特医食品经历了由“药品”向“食品”过渡,其作为“健康中国”、“国民营养计划”和“健康中国行动”背景下重要的手段,满足特定疾病或医学状况下的营养膳食需求,正逐渐受到进食受限、消化吸收障碍、代谢紊乱或特定疾病状态的人群青睐,满足了特定人群机体对能量或营养素的需要。随着国内人口老龄化加速以及慢病患者人数逐年快速增加,对特医食品的需求空间巨大[8]。为进一步促进特医食品的健康发展,有以下几点思考。
3.1 进一步完善相关法律法规
科学、系统、完善的法律法规体系对特医食品行业起到了重要的导向作用。虽然我国也陆续出台了相应的法律法规,形成了较完整的特医食品注册管理体系,但《特殊医学用途配方食品注册管理办法》相关的配套文件仍待进一步规范和完善。如针对不同疾病的特异性代谢状态,需对相应的营养素含量提出特别规定,为患者提供适用的营养支持,从专业层面充实完善特医食品的标准。
3.2 进一步加大研发力度
企业是特医食品研发和生产的主体,应加大对国内外特医食品相关法规政策的学习。以临床价值或需求为导向,基于医学和(或)营养学的研究为证据,研制和生产满足目标人群营养需求的产品,同时应重点关注和监测产品的安全性和临床有效性,进而为研发和生产高质量的特医食品奠定基础。目前,国内申报企业主要集中在食品企业和药品企业,二者均应立足自身优势,不断弥补短板,准确解读国家政策导向和要求,提升创新能力,加大研发力度,加强人才培养,促进特医食品行业的健康发展。
3.3 加强国际交流与合作
国内特医食品行业相比国外发展起步较晚,存在相关法规和政策有待完善、临床应用经验较缺乏等问题[18]。但特医食品在欧洲、澳大利亚及日本等发达国家应用多年,国内可借鉴发达国家成熟的技术与经验,加强同相关政府机构和生产企业的交流与合作,学习研发思路、风险质控等方面知识,增加自身的技术储备,提升国际竞争力。
3.4 加大宣传,提高社会对特医食品的认知
社会对特医食品的认知度,关系到特医食品的合理使用和本行业的健康发展。可通过政策引导、知识宣讲等方式提升社会各界对特医食品的认知;加强对患者和家属的教育,督促医生合理安全使用,既缩短住院时间、加快康复速度,又降低个人、家庭、医疗机构乃至政府的负担[19],也不会出现无法满足患者临床营养需求的尴尬。根据目前特医产品的批准情况,特殊医学用途婴儿配方食品基本达到了全类别覆盖,非全营养产品中应增加增稠组件和流质配方的研发与申报,同时应加大特定全营养配方食品的研发力度。进口企业应尽快了解、熟悉我国注册审批的法律法规、审评流程,将产品备案的思路转移到注册审批上来,达到我国特医食品相应的注册审批要求,充实中国的特医食品市场。
参考文献:
[1] 原国家食品药品监督管理总局. 特殊医学用途配方食品注册管 理办法[Z]. 2016-07-18.
[2] 中华人民共和国国家卫生和计划生育委员会. GB 25596-2010, 食品安全国家标准特殊医学用途婴儿配方食品通则[S]. 北京: 中国标准出版社, 2010.
[3] 中华人民共和国国家卫生和计划生育委员会. GB 29922-2013. 食品安全国家标准特殊医学用途配方食品通则[S]. 北京: 中国 标准出版社, 2013.
[4] 王璐. 解码特殊用途配方食品[N].中国食品安全报, 2013-05- 21(A04).
[5] 《中华人民共和国食品安全法》编写组. 中华人民共和国食品 安全法[M]. 北京: 中国标准出版社, 2015.
[6] Philipson T J, Snider J T, Lakdawalla D N, et al. Impact of oral nutritional supplementation on hospital outcomes[J]. Am J Manag Care, 2013, 19(2): 121-128.
[7] Cederholm T, Barazzoni R, Austin P, et al. ESPEN guidelines on definitions and terminology of clinical nutrition [J]. Clin Nutr, 2017, 36(1): 49-64.
[8] 宁俊, 张茜, 王新明, 等. 国内外特殊医学用途配方食品发展概 况[J]. 生物产业技术, 2018, (6): 68-74.
[9] 中华人民共和国国家卫生和计划生育委员会. GB 29923-2013 食品安全国家标准特殊医学用途配方食品良好生产规范[S]. 北 京: 中国标准出版社, 2013.
[10] 原国家食品药品监督管理总局. 特殊医学用途配方食品临床试 验质量管理规范(试行)[Z]. 2016-10-13.
[11] 原国家食品药品监督管理总局. 特殊医学用途配方食品标签、 说明书样稿要求(试行)[Z]. 2016-07-13.
[12] 原国家食品药品监督管理总局. 特殊医学用途配方食品注册生 产企业现场核查要点及判断原则(试行)[Z]. 2016-09-23.
[13] 原国家食品药品监督管理总局. 特殊医学用途配方食品注册申 请材料项目与要求(试行)[Z]. 2017-09-05.
[14] 原国家食品药品监督管理总局. 特殊医学用途配方食品稳定性 研究要求(试行) [Z]. 2017-09-05.
[15] 原国家食品药品监督管理总局. 特殊医学用途配方食品名称规 范原则(试行) [Z]. 2017-07-24.
[16] 国家市场监督管理总局. 特殊医学用途配方食品生产许可审查 细则[Z]. 2019-01-29.
[17] 国家市场监督管理总局. 特定全营养配方食品临床试验技术指 导原则(糖尿病)、特定全营养配方食品临床试验技术指导 原则(肾病)、特定全营养配方食品临床试验技术指导原则 (肿瘤)[Z]. 2019-09-27.
[18] 特殊医学用途配方食品(FSMP)临床管理专家共识(2021 版)[J]. 中国医疗管理科学, 2021, 11(4): 91-96..
[19] 周子琪, 苟茂琼, 胡雯, 等. 中国特殊医学用途配方食品行业现 况及探索[J]. 肿瘤代谢与营养电子杂志, 2021, 8(4): 439-444.
素材来源网络,如侵删