摘要: 营养不良是外科手术后并发症发生的重要危险因素。不少外科患者,尤其是胃肠道手术患者存在营养不良及营养不良风险,积极开展围手术期营养治疗尤其是术后早期进食有利于外科患者加速康复,改善预后及生活质量。为规范、合理地开展围手术期营养治疗,欧洲肠外肠内营养学会( ESPEN) 于 2021 年 7 月 1 日发表了 2021 版外科患者营养治疗实践指南 ESPEN Practical Guideline: Clinical Nutrition in Surgery。该指南从临床实用性出发,对 2017 年 ESPEN 发布的外科患者营养治疗指南进行缩减,包括外科患者营养治疗的总体原则和特殊类型外科患者的个体化营养治疗,总计给出 37 条推荐,并添加了流程图,更加便于临床医师、营养师及护士等在临床实践中使用。笔者对该指南进行解读,以供国内同行学习、交流,为我国外科患者营养治疗提供参考。
关键词: 营养治疗;外科学;指南

1 总则
1. 1 术前是否需要禁食
推荐意见1:大部分患者不需要从术前当晚开始禁食。无误吸风险的患者可在麻醉前 2 h 饮用清流质,麻醉前 6 h 进食固体食物。(推荐等级 A———强烈同意)
评价:胃排空清流质需要 60 ~ 90 min。与术前传统禁食 12 h 及以上相比,目前并无证据支持择期手术前 2 h 饮用清流质会增加反流误吸风险。除了急诊手术、胃排空障碍及胃食管反流等特殊情况, 多国麻醉协会已更新指南并建议择期手术前 2 h 饮 用清流质[3-4] 。自指南更新并应用以来,也未有报道发现围手术期反流、误吸及其他相关并发症的发生率与死亡率显著上升。避免禁食是 ERAS 的重要措施之一,允许患者摄入咖啡、茶水等有助于减少口渴感及头痛等戒断症状。
1. 2 择期手术患者使用碳水化合物进行术前代谢准备能否获益
推荐意见 2:手术前夜以及术前 2 h 口 服碳水化合物( 不需要术前禁食禁饮) 有助于减少焦虑等不适(B)。大手术患者可考虑术前使用碳水化合物改善术后胰岛素抵抗和缩短住院时间 (0)。(推荐等级B/0———强烈同意)
评价:术前夜口服 800 ml 或术前口服 400 ml 碳 水化合物并不会增加误吸风险。研究显示,口服碳水化合物有助于提高术后舒适感。柠檬汁术前口服安全,不增加胃排空时间。一项 meta 分析纳入 21 项随机对照试验(randomized controlled trial,RCT) 共 1685 例患者,研究结果显示,在择期手术术前口服碳水化合物的患者中,接受大手术的患者住院时间显著缩短,且术前是否口服碳水化合物不影响并发症的发生率[5] 。另一项纳入 21 项 RCT、1976 例患者的 meta 分析也显示术前口服碳水化合物能缩短住院时间[6] 。最近的一项多中心 RCT 发现,术前口服碳水化合物的患者围手术期每日需注射胰岛素及血糖高于 7. 78 mmol / L 的患者比例显著减少, 临床并发症的发生率较术前无口服碳水化合物患者相比无明显差异。但对于可能出现胃排空障碍的严重糖尿病患者,应避免术前口服碳水化合物。
1. 3 术后是否有必要中断经口营养摄入
推荐意见 3:大部分患者在术后继续口服营养摄入。(推荐等级 A———强烈同意)
评价:早期经口进食是 ERAS 的重要治疗措施。研究发现早期经口进食可显著降低并发症发生率, 缩短住院时间[6] 。胆囊切除术后及结直肠切除术后行胃肠减压或延迟进食对患者并无益处。多数手术后患者可立即开始经口营养治疗。
推荐意见 4:根据个体耐受情况及手术类型调整口服营养方案, 尤其是老年患者应更加谨慎。(推荐等级 GPP———强烈同意)
评价:与常规开放手术相比,腹腔镜下结肠切 除术后肠道动力及功能恢复更快,患者可更早耐受 口服营养。经口进食的初始剂量应根据患者的胃 肠道功能及耐受能力进行调整。一项多中心 RCT 研究发现,ERAS 能缩短腹腔镜手术患者住院时 间[7] 。另一项 meta 分析发现腹腔镜手术联合 ERAS 有助于降低重大并发症发生率并缩短住院时间[8] 。因此,同时开展多项 ERAS 措施时早期经口进食的 优势可能并不能充分体现。
推荐意见 5:大部分患者在术后数小数内即可开始恢复流质等经口摄入。(推荐等级 A———强烈同意)
评价:术后第 1 天或第 2 天早期进食包括清流质在内的普食或肠内营养(enteral nutrition,EN)并不会影响结直肠吻合口的愈合,反而可显著缩短住院时间。最近的 meta 分析也发现早期进食有助于加速术后康复并减少感染等并发症,但对死亡率、 吻合口漏发生率、肠道功能恢复情况及住院时间无显著影响。研究发现,全胃切除和部分食管切除术后患者也可开展早期经口进食[9-10] 。一项 meta 分析纳入 2112 例上消化道手术患者,研究结果发现, 早期经口进食的患者术后住院时间显著缩短,吻合口漏等并发症发生率并无显著差异[11] 。
2 营养治疗的指征( 图 1)
2. 1 外科患者何时进行营养评估和营养治疗
推荐意见 6:推荐在大手术前后评估患者的营养状况。(推荐等级 GPP———强烈同意)
评价:外科术后并发症发生率及死亡率与营养 状况相关。经口进食量不足超过 14 d 是死亡率升高的危险因素。两项多因素分析研究发现营养不良是住院手术患者并发症发生率、死亡率升高,住院时间延长及费用增加的独立危险因素[12-13] 。
推荐意见 7:对存在营养不良及营养风险的患者应开展围手术期营养治疗。若预计围手术期超过 5 d 无法经口进食,或经口进食低于 50%推荐摄入量超过 7 d,也应尽快开展围手术期营养治疗[ 首选肠内途径,包括口服营养补充( oral nutritional sup- plement,ONS)和管饲营养]。(推荐等级 GPP——— 强烈同意)
评价:外科患者营养治疗的主要目的是预防和治疗营养不良。如患者长期禁食或存在严重代谢消耗,应在术前纠正营养不良并在术后维持营养状态。术后并发症发生率、死亡率及住院时间可反映营养治疗的效果。可用营养状态改善情况及生活质量来评估出院后及以姑息性治疗为目的的营养治疗效果。排除下列禁忌证后,首选经肠途径开展营养治疗:1肠梗阻或肠麻痹;2严重休克;3消化 道缺血;4瘘引流量多;5严重消化道出血。两项 meta 分析的结果提示术后 24 h 内开展早期 EN 的患者预后更佳[14-15] 。美国肠外肠内营养学会(A- merican Society for Parenteral and Enteral Nutrition, ASPEN)2016 年的指南也推荐在条件允许时应在术后24 h内开展EN。
推荐意见 8:若单独经口和经 EN 无法满足能量及营养需求(<50%能量需求)超过 7 d,推荐联合使用 EN 与肠外营养(parenteral nutrition,PN)(GPP)。若患者需要营养治疗但存在 EN 禁忌(如肠梗阻), 推荐尽早开展 PN(A)。(推荐等级 GPP/A———强 烈同意)
评价:Mazaki T 等[16] 的 meta 分析发现 EN 有助于降低胃肠道术后感染及吻合口漏的发生率并缩短住院时间。Zhao XF 等[17] 的 meta 分析则发现术后 EN 有助于缩短排气时间及住院时间并升高白蛋白水平,但对死亡率并无显著改善。以下患者更适 合使用PN:不耐受或无法施行 EN 的营养不良患者;术后并发症影响消化道功能且至少 7 d 内无法经口进食或 EN;营养消化吸收不足。术后早期消化道功能障碍时能量摄入较低,PN 优势更明显。此外,PN 可满足严重创伤等消化道耐受不佳患者的能量需求。EN 联合 PN 有助于提高能量摄入,但在择期手术后联合应用的有效性还有待证实。尽 管研究提示咀嚼口香糖有助于消化道功能恢复, 然而在 ERAS 实施下其效果可能无法通过 RCT 体现。
推荐意见 9:PN 应以全合一( 三腔袋或药房配置)形式给予,而不是多瓶分开输注。(推荐等级 B———强烈同意)
评价:多项研究发现使用全合一( 三腔袋) 的经济效益优于多瓶系统,且三腔袋可显著降低血流性感染的发生率[18-19] 。
推荐意见 10:推荐按照标准操作流程( standard operating procedure,SOP)进行营养治疗以保障营养治疗的有效性。(推荐等级 GPP———强烈同意)
评价:营养治疗流程和 SOP 有助于提高医疗安全性,更易达到能量目标。长期全肠外营养(total parenteral nutrition,TPN) 需兼顾充足的微量营养素摄入。
2. 2 谷氨酰胺的使用指征
推荐意见 11:EN 无法满足营养需求而必须行 PN 的患者推荐使用肠外谷氨 酰胺添加制剂。( 推荐等级 0———强烈同意)
评价:多数需要 PN 的患者病情复杂棘手,并在重症监护室(intensive care unit,ICU) 治疗。既往 meta 分析结果提示补充谷氨酰胺有助于降低术后感染发生率,缩短住院时间[20] 。然而一项大型 RCT 结果显示,胃肠道大手术的术前 5 d 和术后通过 PN 途径以0.4 g/(kg·d)的剂量补充二肽,营养状况良好患者的术后并发症发生率和住院时间并未明显改善[1] 。另一项 RCT 则发现重症患者每日添加 0.5g/kg谷氨酰胺并无显著改善其死亡率及感染率[21] 。尽管有学者认为谷氨酰胺有益,目前并无文献强烈支持 PN 中添加谷氨酰胺。对于包括结直肠手术在内的大部分患者,并无必要使用 PN,肠外途径添加谷氨酰胺配合经口进食或 EN 可能有效,但目前缺乏足够的证据支持。
2. 3 单独补充精氨酸( 经静脉或肠内) 的指征
单独经静脉或肠内补充精氨酸的证据尚不充分,暂无法对精氨酸的单独使用给出明确推荐意见(0)。
评价:以谷氨酰胺为单一底物的经口营养研究数据不足。研究发现胰腺术后患者经口摄入不足, 抗氧化物及绿茶提取物可显著升高血浆维生素 C 并在不影响氧化应激及炎症反应的情况下改善总抗氧化能力[22] 。
2. 4 静脉补充 ω-3 脂肪酸的指征 推荐意见 12:术 后 PN(含 ω-3 脂肪酸)仅在 EN 不能满足营养需求的情况下考虑使用。(推荐等级 B———大部分同意)
评价:最近多项研究发现使用含 ω-3 脂肪酸的 PN 有助于降低术后感染率,缩短住院时间。Tian H 等[23] 的 meta 分析结果发现使用含大豆油、中链甘油三酯、橄榄油及鱼油的混合乳剂较其他橄榄油混合中长链甘油三酯乳剂并无明显优势。其他研究也 认为大部分患者,尤其是结直肠手术患者使用 TPN 的意义有待商榷。鉴于这些研究的方法学差异,本推荐仅给予B级推荐。术后72h内短期使用ω-3脂肪酸可能有效,但其效果需要进一步研究证实。
2. 5 富含免疫营养素的特殊口服 / EN 配方的使用指征
推荐意见 13:推荐行肿瘤大手术的营养不良患者在围手术期或至少在术后使用富含精氨酸、ω-3 脂 肪酸、核糖核苷酸的特殊营养制剂(B)。目前尚无充分证据证明术前单独使用含此类特殊免疫营养制剂的 ONS 的效果优于普通 ONS。( 推荐等级 B / 0———同意)
评价:多项 meta 分析发现围手术期使用免疫营养制剂有助于降低术后并发症发生率,缩短住院时间。目前研究的免疫营养制剂以精氨酸、ω-3 脂肪 酸及核糖核苷酸为主。围手术期免疫营养制剂的应用还存在争议,研究发现其可降低腹部肿瘤大手术后并发症发生率,缩短住院时间,营养不良的患者则受益更多。一项 meta 分析发现与医院配餐相比,术前使用免疫营养制剂可显著降低感染并发症,且与标准营养治疗组也存在差异趋势[24] 。而术前使用免疫营养制剂的经济效益可能通过降低并发症发生率实现。
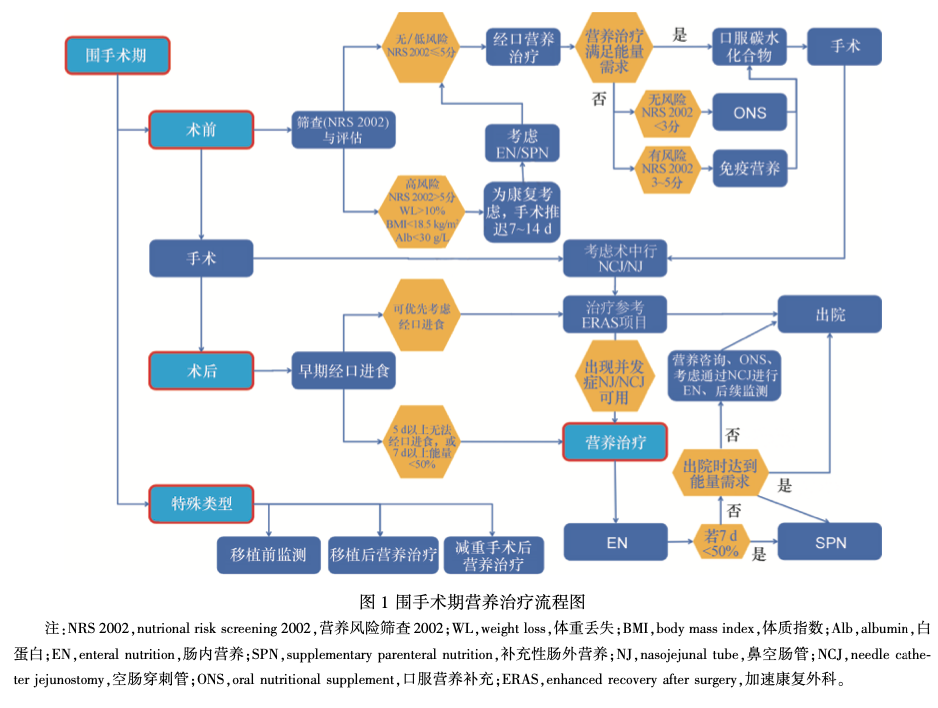
3 术前营养治疗(图 2)
3. 1 哪些患者可以从术前营养治疗中获益
推荐意见 14:有严重营养风险的患者在大手术前应接受营养治疗( A) ,即使是对肿瘤患者也应该推迟手术[ 生物临床终点(biomedical endpoint,BM)]。一般来说,营养治疗时间为 7~14 d 较为合适(0)。(推荐等级 A / 0———强烈同意)
评价:大手术前,严重营养不良患者需通过营养治疗调整全身情况。两项 meta 分析发现术前开展至少 7 ~ 10 d 营养治疗有助于改善术后并发症[25-26] 。一项研究发现 800 例严重营养不良的胃癌手术患者在术前 10 d 摄入充足能量后,术区感染的发生率显著低于低能量或无能量补充的患者[27] 。另一项研究也发现营养治疗是感染发生率降低的 独立因素[28] 。
推荐意见 15:经口或肠内途径是营养治疗的首 选。(推荐等级 A———强烈同意)
评价:接受多模式治疗的肿瘤患者应尽早开始营养干预。上消化道梗阻时须通过 PN 提供营养, 条件允许可采取经口进食。为避免严重营养不良患者出现再喂养综合征,应根据实验室检查结果及心功能情况逐步增加 PN,及时补充电解质及维生 素。Jie B 等[29] 采用营养风险筛查 2002(nutritional risk screening 2002,NRS 2002) 筛查 1085 例腹部手术患者后发现,512 例患者存在营养风险,术前营养治疗可有效减少 NRS 2002>5 分患者的术后并发症发生率及住院时间;NRS 2002 评分 3 ~ 4 分的患者术前无论是否接受营养治疗,其感染发生率及住院时间均无差异。
3. 2 术前使用口服营养补充 / EN 的时机
推荐意见 16:当正常饮食无法满足患者的能量需求时,无论其营养状态如何都推荐在术前使用 ONS。( 推荐等级 GPP ——— 强烈同意 )
评价:ONS 可作为营养的唯一来源,其配方应达到标准化、营养均衡、疾病通用且符合特殊医学用途配方食品 ( foods for special medical purpose, FSMP)标准。由于常规饮食无法满足多数患者的能量需求,因此需要在术前使用标准化 ONS。在三项研究术前营养治疗的 RCT 中,一项研究发现 ONS 组轻微并发症的发生率显著降低,另两项研究结果则显示 ONS 组与对照组相比无显著差异[30-32] 。大部分结直肠手术患者不存在营养风险这一说法仍存在争议,但这可能解释了为何此类患者营养治疗的结果与对照组无显著差异。值得注意的是,Bur- den ST 等[33] 研究发现 ONS 有助于降低体重下降患者的外科感染发生率。除此之外,术后继续营养治疗有助于减少术后体重丢失,并减轻住院患者的经济负担。
推荐意见 17:推荐所有营养不良的肿瘤患者或营养不良高风险患者在腹部大手术前使用 ONS。老年肌肉减少症患者是一类特殊的营养不良高危人群。(推荐等级 A———强烈同意)
评价:详见评价 14 和 16。
推荐意见 18:推荐术前使用含精氨酸、ω-3 脂肪酸及核糖核苷酸的免疫调节型 ONS(0),并建议在术前使用5~7 d(GPP)。(推荐等级0/GPP——— 大部分同意)
评价:详见评价 13。向患者解释 ONS 的潜在获益有助于激发依从性。
推荐意见 19:推荐在入院前开展术前 EN 或 ONS 以避免不必要的住院并降低院内感染率。( 推 荐等级 GPP———强烈同意)
评价:入院前开展营养治疗经济实惠,有助于降低医院感染发生率,详见评价 13 和 18。
3. 3 术前使用 PN 的指征 推荐意见 20:对营养不良或营养不良高风险患者,若 EN 无法满足能量需求,术前应使用 PN(A)。推荐术前 PN 使用时间为 7~14d(0)。(推荐等级A/0———强烈同意)
评价:目前研究证实胃肠道大手术前 7 ~ 14 d 使用 PN 仅对严重营养不良( 体重丢失 10% ~ 15%) 患者有益[34] 。术前 10 d 使用 PN 可降低死亡率并使术后并发症发生率降低 30%。近年的研究发现胃肠道手术患者术前使用 PN 使术后并发症发生率 从45%降低至28%[35]。术前7d使用PN可一定程 度上提高机体功能及全身蛋白水平,但术前使用 2 周才会得到显著改善。目前暂无研究对比术前 7 d 和14d使用PN的差异。此外,尽管术前10~14d 开始 PN 会延长住院时间,但对存在严重营养风险的患者而言是值得的。
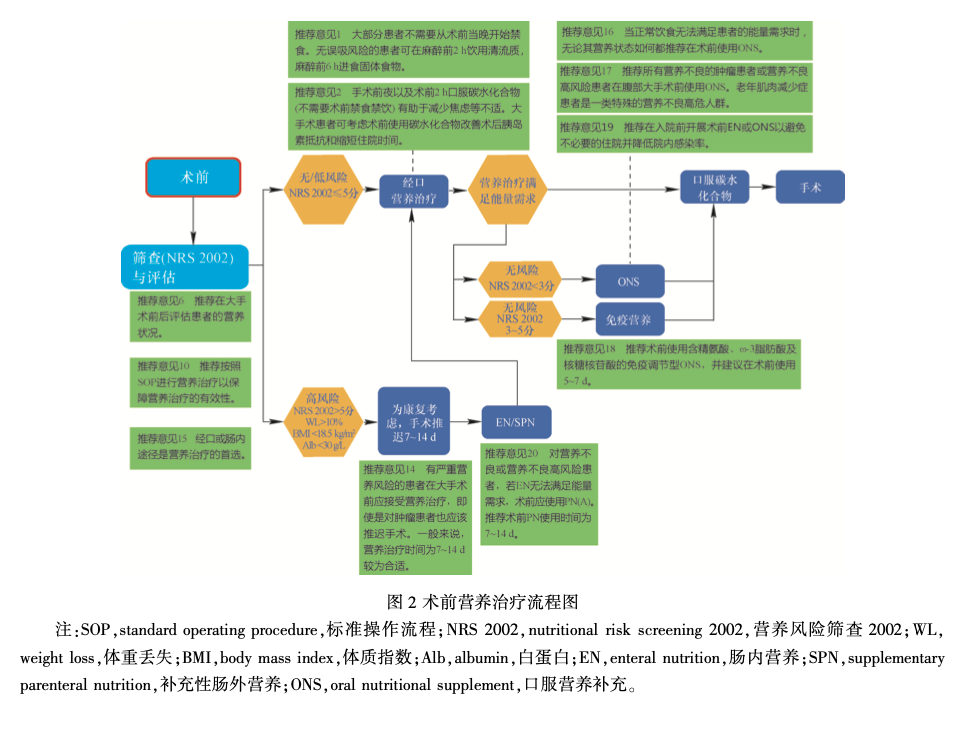
4 术后营养治疗(图 3 和图 4)
4. 1 哪些患者可以从术后早期 EN 中获益
推荐意见 21:对早期无法经口进食或经口摄入量无法满足营养需求(<50%)超过7d的患者,应术后早期(24 h 内)实施 EN,包括接受头颈部大手术或胃肠道肿瘤手术的患者(A),脑损伤等严重创伤患 者(A),围手术期存在明显营养不良的患者 (A)(GPP)。(推荐等级 A/ GPP———强烈同意)
评价:最近研究发现,部分或全胃切除术后、微创食管切除术后及全喉切除术后立即开始经口营养治疗是安全的[36] 。头颈部及腹部大手术患者术前常存在营养不良,术后感染并发症发生率较高。术后水肿、梗阻及胃排空障碍常延迟经口进食时间,使患者的营养需求难以得到满足,其他术后并发症也会导致经口或经肠营养治疗延迟,影响预期能量摄入。进行 PN、EN 及免疫营养治疗有利于增加患者的营养摄入,改善临床结局。即使正常营养状况的患者在创伤后发生感染及器官衰竭的并发症发生率也较高,早期 EN 有助于降低感染发生率。24 h 内开始 EN 还有助于降低多器官衰竭的发生 率[37] 。头部创伤患者也可开展早期进食以降低感染发生率,改善生存率及致残率。
4. 2 营养制剂的配方如何选择
推荐意见 22:标准整蛋白配方适用于大部分患者。从堵管及感染风险等技术原因考虑,一般不推荐使用家庭自制食物开展 EN。(推荐等级 GPP———强烈同意)
评价:大部分患者可采用标准化制剂行营养治疗,通过空肠造瘘管经小肠行营养治疗,不使用寡肽也能改善营养状态。若考虑使用自制 EN,应在家庭护理场景展开,且应单人单制,避免批量制作导致营养制剂污染。
4. 3 术后如何选择管饲方式
推荐意见 23:对需要 EN 的上消化道及胰腺大手术的营养不良患者,应放置鼻肠管或空肠穿刺管进行营养治疗。( 推荐等级 B———强烈同意)
评价:术中放置鼻肠管或通过造瘘进行营养治疗简单方便且患者获益更多。专科医师在开放手术或腹腔镜手术中按标准操作放置空肠穿刺管(needle catheter jejunostomy,NCJ) 的并发症发生率可低至 1. 5% ~ 6%[38] 。有学者认为普通患者不需要常规放置 NCJ,仅建议高危患者使用。一项研究发现行食管切除术的患者长期通过 NCJ 行 EN 有助于降低吻合口并发症的发生率[39] 。另一项研究则发现尽管住院时间显著缩短,胰十二指肠手术后使用 NCJ 患者的并发症发生率与对照组相比并无显著差异[40] 。近年研究结果也提示食管切除术等大手术后通过 NCJ 行 EN 与使用鼻肠管及 PN 间并无显著差异[41] 。鉴于经鼻导管意外移位在术后早期多发,对存在营养风险的该类患者,通过造瘘管行营养治疗的疗效可能比经鼻导管更佳,并可在出院后继续使用。
推荐意见24:推荐术后24h内开展EN。(推荐 等级 A———强烈同意)
评价:详见评价 25。
推荐意见25:推荐从低流量(如10~20 ml/h) 开始,逐步根据患者个体肠道耐受程度缓慢提高滴速。每个患者达到目标摄入量的时间不同,可能需要5~7d。(推荐等级GPP———同意)
评价:存在胃肠道功能障碍患者应密切观察其对EN的耐受程度,EN开始5~7d后才能完全满足患者的营养需求[42] 。喂养过量或过快可导致肠道缺血及死亡率升高。
推荐意见 26:对严重头颅创伤等需长期实施 EN(>4 周)的患者,推荐采用经皮导管途径(如经皮内镜胃造瘘术)开展 EN。(推荐等级 GPP———强烈同意)
评价:严重头部创伤及神经外科手术等非腹部手术患者若需长期使用 EN,应考虑使用经皮内镜胃造瘘术(percutaneous endoscopic gastrostomy,PEG)。食管癌伴上消化道梗阻或需新辅助放化疗后择期手术的患者可在手术医师指导下在术前通过 PEG 行营养治疗。指南建议需要通过 EN 开展营养治疗 2~3 周的患者可使用 PEG[43] 。
4. 4 哪些患者出院后可以从 EN 中获益 推荐意见 27:对围手术期接受营养治疗但通过经口摄入未达到能量需求的患者,住院期间应定期进行营养评估,必要时在出院后应继续进行包括营养咨询在内的营养治疗。(推荐等级 GPP———强烈同意)
评价:即使围手术期已开展营养治疗,术后并发症的发生及体重丢失依旧不可避免,患者仍存在营养状况恶化风险,出院后需继续随访营养状态。除此之外,胃肠道及胰腺大手术后患者长时间经口能量摄入不足,存在营养不良风险。研究发现食管切除术后 6 个月,患者的体重丢失为 5% ~ 12%,超过半数患者术后 12 个月体重丢失超过 10%[44] 。因此,强烈建议常规对患者进行饮食指导。术中放 NCJ 的优点在于可在出院后继续使用,NCJ 每日可经肠提供 500 ~ 1000 kcal 的能量,患者在经培训后可自行管饲。尽管研究并未发现术后及出院后常规使用 ONS 对疾病预后产生影响,但与普通饮食相比,ONS 对患者的营养状态、舒适感、生活质量及并发症发生率有着显著的改善,这对胃肠道大手术、 结直肠切除术及老年伴骨折的患者尤为适用。老年患者营养治疗的依从性低,使用 ONS 有助于提高总能量摄入[44] 。
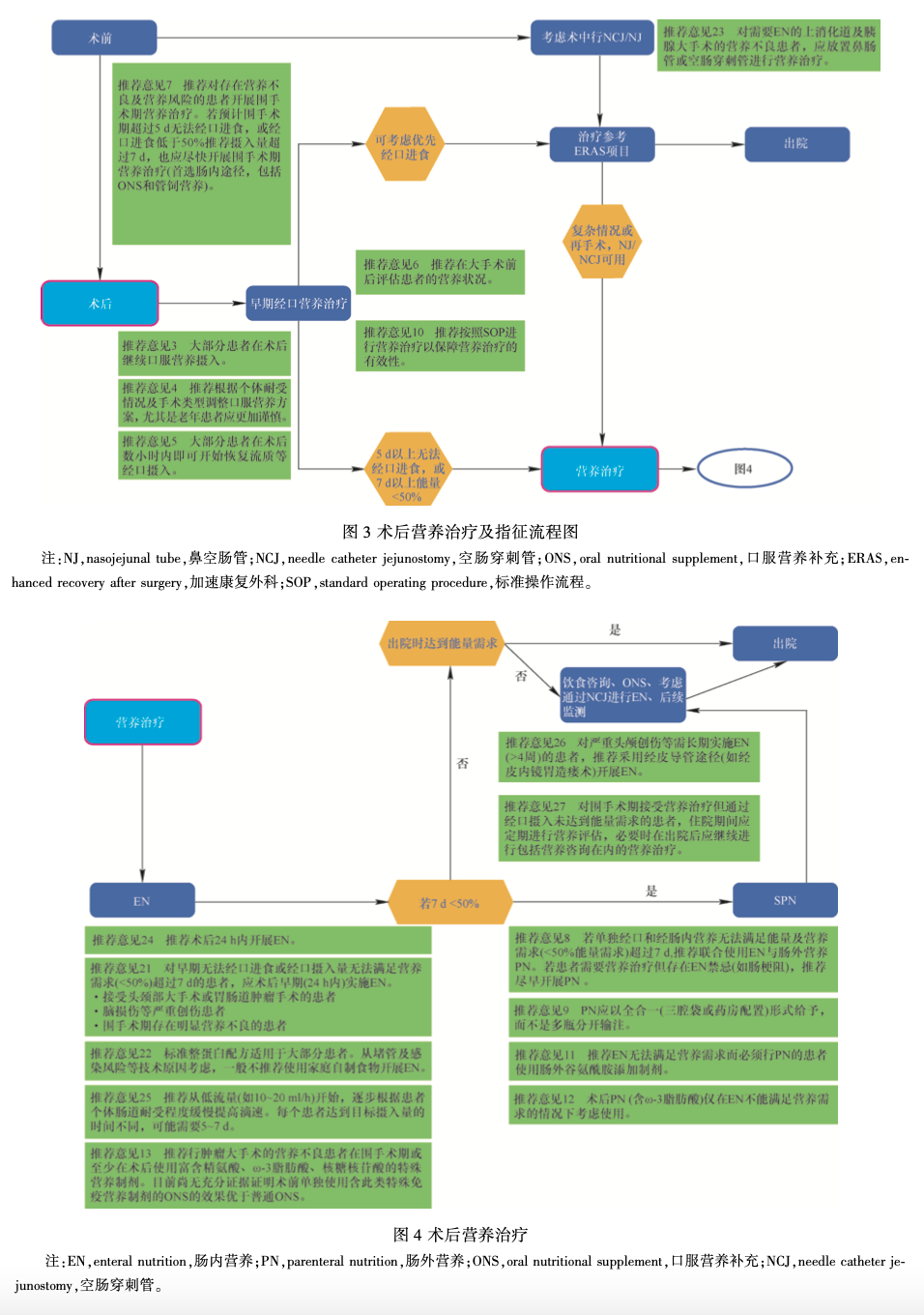
5 器官移植(图 5)
5. 1 实体器官移植前 EN 的指征
推荐意见 28:营养不良是影响移植结局的重要因素,因而推荐开展营养状况监测,并对营养不良患者使用 ONS 或 EN。(推荐等级 GPP———强烈同意)
评价:营养不良可造成心血管疾病及呼吸功能障碍等潜在慢性病进展恶化,全身器官功能受损。肝移植等待患者常存在能量负平衡,与肝病加重有关[45] 。移植后饮食组成不均衡,总能量及蛋白质摄入不足很常见。移植前后应关注并改善患者的营养状态。研究发现营养治疗有助于改善营养相关指标。
推荐意见 29:对等待移植的患者应开展定期营养评估和营养咨询。(推荐等级 GPP———强烈同意)
评价:除营养不良外,肥胖也是影响器官移植患者结局的重要代谢危险因素。因此,肥胖及代谢综合征患者也需要营养监测及营养治疗以减重来降低风险。肝移植前等待期及术后 5 d 行免疫营养治疗有助于改善患者的总蛋白量并降低感染发生率[46] 。一项研究发现,23 例肝移植活供体术前 5 d摄入富含抗氧化剂的营养补充可提高抗氧化能力,但免疫球蛋白水平及其他临床指标并无显著差异[47]。
推荐意见 30:移植供体与受体的营养治疗推荐与腹部大手术患者相似。(推荐等级 GPP———强烈同意)
评价:有关( 肝) 供体及受体术前代谢准备的研究有限。目前数据支持术前通过饮用碳水化合物进行代谢准备,以改善患者的营养状态并减少肝脏保存损伤。肝病患者的 EN 应用原则可参见肝病指南[48]。
5. 2 实体器官移植后何时开始营养治疗 推荐意见 31:心、肺、肝、胰腺及肾脏移植术后 24 h 内应早期经口正常进食或使用 EN。( 推荐等级 GPP———强烈同意)
评价:移植患者应早期恢复正常饮食或开始 EN。营养摄入不足的患者应联合使用 PN,肝移植患者可考虑行 NCJ。肝移植后 48 h 内能量摄入应< 18 kcal/(kg·d),有利于在术后早期保护移植物功能[28,48] 。他克莫司的吸收和血药浓度不受 EN 的影 响。肝移植术后使用 EN 的效果和 PN 相当,且有助于降低病毒及细菌感染率。与添加选择性消化道去污染剂的标准 EN 制剂及仅含纤维的补充剂相比,含植物乳杆菌等益生菌的高可溶性纤维配方可显著降低感染率[49] 。
推荐意见 32:即使是小肠移植,术后也可早期启动 EN,但 EN 第 1 周应注意缓慢加量。( 推荐等级 GPP———强烈同意)
评价:即使 EN 增加小肠分泌量,小肠移植术后第 1 周也可使用低流量 EN。研究发现 21 例小肠移植患者术后行空肠管饲后微量营养素及矿物质不足,故应注意监控并及时补充[50] 。
推荐意见 33:必要时 EN 与 PN 可联合使用。推荐对所有移植患者开展长期营养监测及营养咨询。(推荐等级 GPP———强烈同意)
评价:对于肝移植患者而言,EN 和 PN 同等重要。中长链脂肪乳剂与长链脂肪乳剂在机体的代谢并无差异,但有助于改善肝移植后网状内皮系统再生。常规营养治疗多在经口联合 PN 营养制剂中添加 20%的中长链脂肪乳剂,而在肝移植术后 7 d 使用 ω-3 鱼油脂肪乳剂有助于改善缺血再灌注移植物损伤及感染的发生率,缩短术后住院时间[51] 。许多肝移植患者机体组成不足,需要长期的营养监测和饮食指导。有研究发现肾移植术后患者的脂肪含量升高而瘦体组织含量下降,肥胖患者的移植肾功能则不如 BMI 正常的患者。虽然暂无数据支持服用鱼油可改善临床结局,但患者及移植后存活 者在术后仍可考虑使用鱼油以改善肾功能,降低排异率、高密度脂蛋白胆固醇水平及舒张压[52] 。
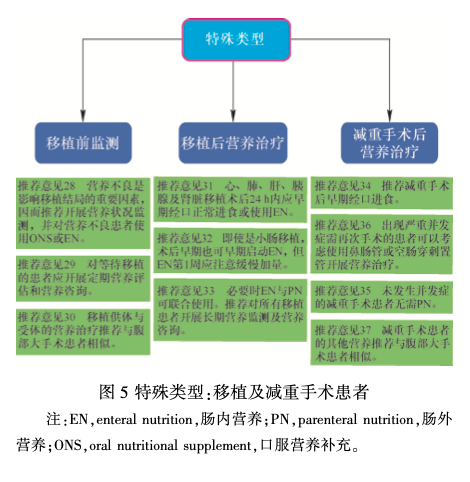
6 减重手术
6. 1 减重手术围手术期何时进行营养治疗
推荐意见34:推荐减重手术后早期经口进食。(推荐等级 0———强烈同意)
评价:减重手术患者的营养治疗不仅限于围手术期,减重手术患者同样需要 ERAS。标准化营养治疗流程有利于营养计划的实施并提高质量。 术前应筛查营养不良及维生素缺乏,并定期复查。 一项研究发现,与标准营养治疗相比,腹腔镜 Roux-en- Y 旁路手术术前给予负荷量碳水化合物及术后 PN 疗效更佳[53] ,即使 2 型糖尿病患者行营养干预也是安全的,两组间营养指标及临床结局并无统计学差异。减重手术后应尽早开展经口进食,其营养治疗原则与其他上消化道手术无异,临床实践可参考美国相关学会指南[53] 。
推荐意见 35:未发生并发症的减重手术患者无需 PN。(推荐等级 0———强烈同意)
评价:普通患者可采用低能量营养,无需额外 PN。外科因素导致体重丢失的患者胃肠道功能多处于正常状态,考虑到导管相关并发症的高发生率,指南并不推荐常规行 PN。
推荐意见 36:出现严重并发症需再次手术的患者可以考虑使用鼻肠管或空肠穿刺置管开展营养治疗。(推荐等级 0———同意)
评价:存在严重并发症的减重手术患者也可通过 EN 获益。 使用 NCJ 或 PEG 的肥胖患者术后吻合口漏发生率较高,可以考虑在术中留置鼻肠管,但仍应慎重考虑通过鼻肠管、NCJ 及残余胃造瘘行 EN[54] 。
推荐意见 37:减重手术患者的其他营养推荐与腹部大手术患者相似。(推荐等级 0———强烈同意)
评价:建议早期开展术后进食,蛋白质供给需达到每日需求量(60 g/ d)。 需要注意的是,标准化经口营养补充制剂含糖量高,减重手术患者服用容易发生倾倒综合征,术后需要专业的随访小组进行营养咨询,监控体重,并警惕微量营养素和维生素不足的发生,注重骨骼健康。尽管暂无研究数据支持,但仍强烈建议该类患者开展体育活动锻炼。
素材来源网络,如侵删