贾海先 1 ,李春雨 1 ,梁栋 2 ,李湖中 2 ,陈忠辉 1 ,于博 1 ,韩军花 3
,赵耀 1
(1. 北京市疾病预防控制中心,北京市预防医学研究中心,北京 100013; 2. 国家食品安全风险评估中心,北京 100022; 3. 中国营养学会,北京 100053 )
DOI:10.13590/j.cjfh.2021.04.018
摘 要:
目的分析我国通过注册审批的特殊医学用途配方食品产品情况、食品标签及营养成分等特点。
方法收集整理截止2021年3月5日,国家市场监督管理总局发布的通过注册审批的特殊医学用途配方食品产品相关信息及食品标签数据,分析产品分类情况、营养成分含量、原料特点等,并与标准规定进行比对分析。
结果目前我国通过注册审批的特殊医学用途配方食品产品共58个。产品营养成分的标签标示值多处于“略高于标准下限~范围中间值”区间内。50%以上的产品选择添加胆碱、肌醇、牛磺酸和左旋肉碱,全营养配方中膳食纤维使用比例达72.2%。
结论我国已批准注册的特殊医学用途配方食品种类基本实现全覆盖,但缺少特定全营养配方、非全营养配方食品中的部分类型,国内企业亟需加大产品研发力度。产品营养成分含量在标准规定的较为理想的范围内。
关键词: 特殊医学用途配方食品; 婴儿; 批准; 营养成分含量
特殊医学用途配方食品是指为满足进食受限、消化吸收障碍、代谢紊乱或特定疾病状态人群对营养素或膳食的特殊需求,专门加工配制而成的配方食品[1]。为科学有序管理特殊医学用途配方食品,一些国际组织和发达国家均针对性地制定了相应的管理政策和法规。如国际食品法典委员会(Codex Alimentarius Commission,CAC)于1991年制定了特殊医学用途食品标签和声称法典标准(CODEX STAN 180—1991)[2],欧盟、美国、日本、澳大利亚/新西兰等也有完善的法规体系和丰富成熟的产品类型[3]。我国于2010年发布《特殊医学用途婴儿配方食品通则》(GB 25596—2010),2013年发布《特殊医学用途配方食品通则》(GB 29922—2013)、《特殊医学用途配方食品良好生产规范》(GB 29923—2013)和《预包装特殊膳食用食品标签》(GB 13432—2013)几项食品安全国家标准及问答[1,4-8]。2016年7月1日,《特殊医学用途配方食品注册管理办法》发布,对特殊医学用途配方食品实施注册审批制度。2017年,发布《特殊医学用途配方食品注册申请材料项目与要求(试行)》,指导企业做好产品注册相关工作。2019年,国家市场监督管理总局发布《特殊医学用途配方食品生产许可审查细则》,规范特殊医学用途配方食品生产许可活动,进一步加强特殊医学用途配方食品安全监管。此外,还制定发布了针对糖尿病、肾病、肿瘤患者的《特定全营养配方食品临床试验技术指导原则》以及广告审查、现场核查等方面的规定和要求。在一系列法规标准保障和指导下,我国特殊医学用途配方食品产业逐渐发展壮大,但也暴露出不少短板和薄弱环节,比如产品体系不健全、配方创新性不强等。为进一步推动完善我国特殊医学用途配方食品法规标准体系,促进特殊医学用途配方食品产业发展,有必要对已获批准注册的产品进行梳理和科学性比对分析,全面了解产品的基本情况、食品标签、营养成分含量及原料特点等。
本研究中,我国通过注册审批的特殊医学用途配方食品产品信息及食品标签数据来源于国家市场监督管理总局特殊食品信息查询平台[9]、国家药品监督管理局政务服务门户特殊医学用途配方食品批件发布[10]和总局食品审评中心特殊医学用途配方食品批件发布[11]。根据规定,实际产品的食品标签要与注册审批的标签保持一致。
摘录我国通过注册审批的特殊医学用途配方食品产品相关信息及食品标签数据和产品标准(含问答)[1,4,7-8]中规定的营养组成要求,对特殊医学用途配方食品标签标示营养成分含量与标准规定量(每100 kJ能量)进行比对,得出范围值和平均值;统计产品具体分类情况、可选择成分添加及配料使用情况。采用WPS表格2016软件进行数据录入整理、汇总和分析。
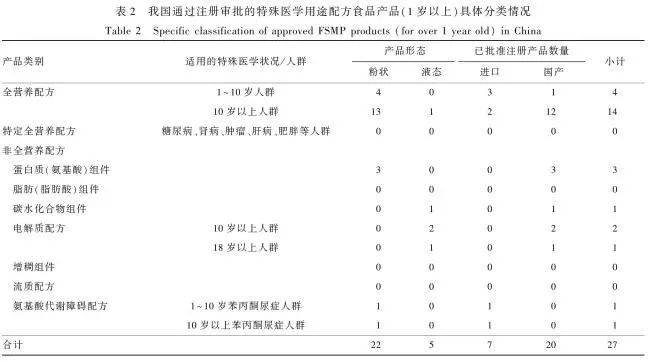
截至2021年3月5日,我国通过注册审批的特殊医学用途配方食品产品共有58个(粉状51个,液态7个)。其中,适用于12月龄及以下婴儿的产品有31个,包括无乳糖配方6个、乳蛋白部分水解配方6个、乳蛋白深度水解或氨基酸配方4个、早产/低出生体质量婴儿配方11个、母乳营养补充剂3个、氨基酸代谢障碍配方1个;适用于1岁以上人群的产品有27个,包括全营养配方18个、非全营养配方9个(电解质配方3个、氨基酸代谢障碍配方2个、蛋白质组件3个、碳水化合物组件1个),尚无特定全营养配方。从生产企业来看,国内企业生产的产品29个,进口产品29个。国内企业生产的特殊医学用途全营养配方和非全营养配方食品多于国外企业,而其生产的特殊医学用途婴儿配方食品少于国外企业。具体情况见表1和表2。
表1 我国通过注册审批的特殊医学用途婴儿配方食品产品(≤12月龄)具体分类情况Table 1 Specific classification of approved FSMP products for infant (less than or equal to 12 months of age) in China

表2 我国通过注册审批的特殊医学用途配方食品产品(1岁以上)具体分类情况Table 2 Specific classification of approved FSMP products (for over 1 year old) in China
2.2.1 特殊医学用途婴儿配方食品将特殊医学用途婴儿配方食品营养成分表标示的每100 kJ能量营养成分含量与标准规定量之间进行比对发现,产品营养成分的标签标示值多处于“略高于标准下限~范围中间值”区间内,烟酸的平均含量较高;对于可调整范围的营养成分,产品的营养成分含量并未明显增加或减少,见表3。
表3 特殊医学用途婴儿配方食品营养成分含量与标准规定量之间比对(平均值,范围值)Table 3 Comparison between nutrients content and standard requirements of approved FSMP products for infant in China (Mean, Range)
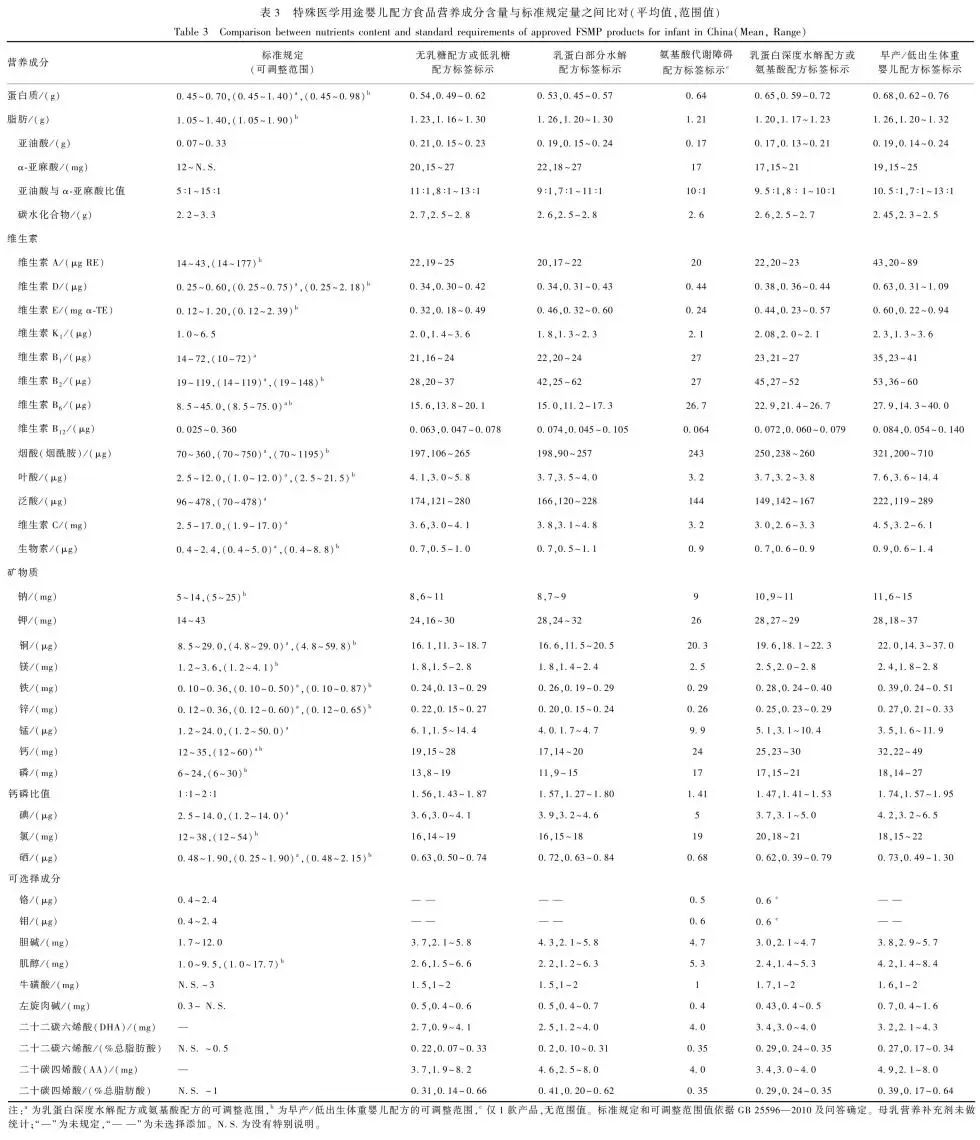
注:a为乳蛋白深度水解配方或氨基酸配方的可调整范围,b为早产/低出生体重婴儿配方的可调整范围,c仅1款产品,无范围值。标准规定和可调整范围值依据GB 25596—2010及问答确定。母乳营养补充剂未做统计;“—”为未规定,“— —”为未选择添加。N.S.为没有特别说明。
2.2.2 特殊医学用途配方食品分别将适用于1~10岁人群及适用于10岁以上人群的特殊医学用途全营养配方食品营养成分表标示的每100 kJ能量营养成分含量与标准规定量之间进行比对发现,除叶酸和锰外,适用于1~10岁人群的产品营养素的标签标示值多处于“略高于标准下限~范围中间值”区间内,见表4。
表4 特殊医学用途全营养配方食品营养成分含量与标准规定量之间比对(平均值,范围值)Table 4 Comparison between nutrients content and standard requirements of approved FSMP products in China (Mean, Range)
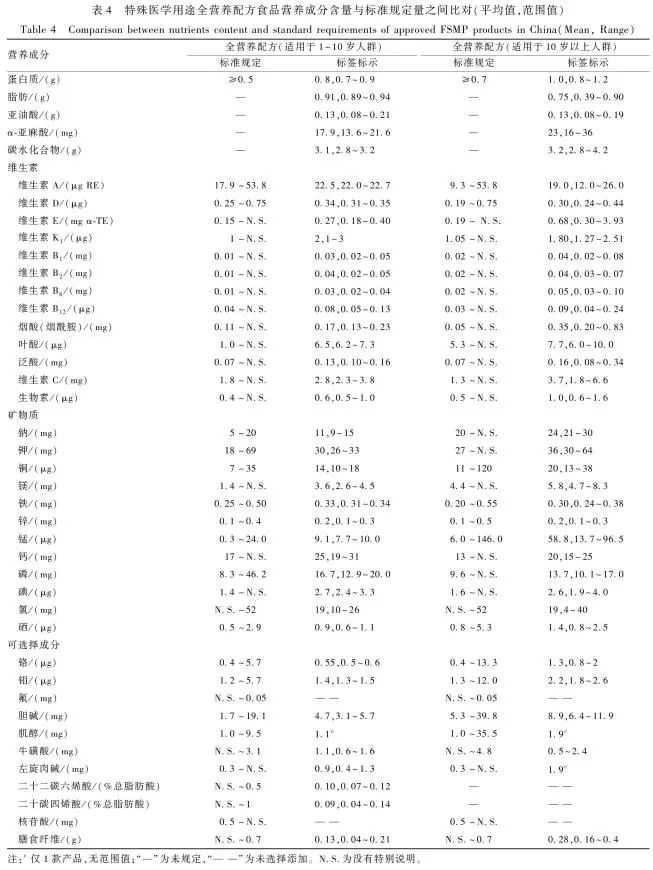
注:c仅1款产品,无范围值;“—”为未规定,“— —”为未选择添加。N.S.为没有特别说明。
根据食品标签,对各产品标示的可选择成分进行分析发现,特殊医学用途婴儿配方食品中,全部添加了胆碱、肌醇、牛磺酸,左旋肉碱、DHA和AA的添加比例均为96.43%(27/28),但仅氨基酸代谢障碍配方和氨基酸配方添加了铬和钼。特殊医学用途全营养配方食品中,50%以上的产品添加了胆碱和牛磺酸,而适用于1~10岁人群的产品均未添加氟和核苷酸,适用于10岁以上人群的产品未添加氟、DHA和AA。此外,部分产品还添加了相应产品标准未规定而《食品安全国家标准 食品营养强化剂使用标准》(GB 14880—2011)中列出的其他成分(配料),如膳食纤维(低聚果糖、低聚半乳糖、菊粉等)、叶黄素、β-胡萝卜素、酪蛋白磷酸肽等,其中特殊医学用途全营养配方食品中膳食纤维使用比例达72.22%(13/18),见表5。
表5 特殊医学用途配方食品可选择成分添加情况(添加数量/类别数量)Table 5 The addition of optional ingredients of FSMP products (No.of additions/No.of categories)
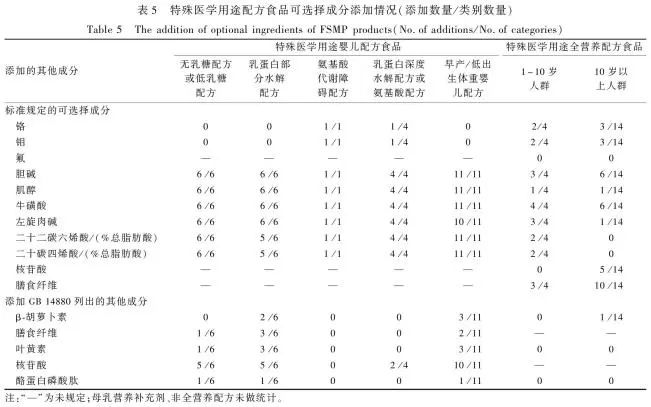
注:“—”为未规定;母乳营养补充剂、非全营养配方未做统计。
在单体氨基酸使用方面,氨基酸代谢障碍配方、乳蛋白深度水解配方或氨基酸配方食品中可添加L型单体氨基酸及其盐类。根据配料分析结果,氨基酸代谢障碍配方、氨基酸配方食品中添加的L型单体氨基酸及其盐类在17种以上。
特殊医学用途配方食品作为“健康中国”、“国民营养计划”和“健康中国行动”背景下一类重要的特殊产品和手段,对于满足特殊医疗状况下特定人群的营养膳食需求、改善其营养状况、降低患者的医疗成本等意义重大。我国在特殊医学用途配方食品方面虽起步较晚,但通过构建“2个产品标准+1个生产规范”的食品安全标准体系以及“1个办法+6个配套文件”的注册管理体系,出台医疗机构特殊医学用途配方食品临床应用管理规范和经营管理规范等,对于特殊医学用途配方食品的监管指导日趋完善[12-13]。但特殊医学用途配方食品行业门槛高,通过审批难度大,要求企业拥有多方面过硬的技术力量,传统乳企、生物医药类企业具有一定优势。从产品通过注册审批的时间和数量来看,2017年批准的产品仅3款,2018、2019年分别达到了18款和22款,2020年至今已批准15款,最新批件发布消息显示有16款注册批件(决定书)待领取[11],申请人均为国内企业,但总体上远低于同属特殊食品的婴幼儿配方食品通过注册审批的数量[9]。在产品分布方面,进口产品在我国特殊医学用途婴儿配方食品体系中已实现全覆盖,而国内企业还无乳蛋白深度水解配方或氨基酸配方、氨基酸代谢障碍配方的相关产品。在非全营养配方食品的营养素组件方面,国内已率先发力,而在特定全营养配方食品、增稠组件和流质配方等方面,国内外企业还无相关产品通过注册审批。其中特定全营养配方食品的注册因需进行临床试验,研发难度大;且目前我国只发布了肿瘤、糖尿病全营养配方食品安全国家标准的征求意见稿,尚无可执行的具体产品标准。总体来看,国产产品体系还不够完善,面对进口产品的竞争力尚待提高。在产品营养成分含量方面,有研究[14]对国内外特殊医学用途婴儿配方食品营养成分的主要差异进行了比较,也有研究[15]对国外不同类型产品配方中营养成分含量、碳氮供热比、渗透压及能量密度的差异进行了分析,但目前尚缺乏对我国批准注册的特殊医学用途配方食品营养成分与标准规定比对的整体研究。本研究发现,58款产品的必需营养成分含量大多处于“略高于标准下限~范围中间值”区间内,表明其营养成分含量在标准规定较为理想的范围内,具有较好的科学性,因为这样一个区间充分考虑了货架期营养成分的损耗,已可保证营养充足性,而且在一定程度上降低了营养负荷过高的风险。同时,标准问答给出了乳蛋白深度水解配方或氨基酸配方、早产/低出生体质量婴儿配方中部分营养成分更高的可调整上限值,结果分析发现两类产品的相应营养成分含量并未明显增加,可能与产品成本控制有关。对于可选择成分的添加,产品结合人群和配方需求以及关注热点,全部或绝大多数添加了胆碱、肌醇、牛磺酸、左旋肉碱、DHA、AA、膳食纤维、核苷酸等生物活性物质,其他可选择成分的添加有所差异,以突出产品配方的特点,这与崔力航和郭睿[16]的研究结果一致。但也存在产品创新性不强和同质化倾向的问题。国内特殊医学用途配方食品行业方兴未艾,机遇与挑战并存[17-18]。为真正推动特殊医学用途配方食品科学有序发展,标准管理部门、企业、临床和科研机构等要形成合力,充分了解国内外特殊医学用途配方食品在法规标准体系、营养成分含量以及营养强化剂使用量、来源等方面的差异和特点[16,19-21],同时结合我国人群和疾病状况特点,在循证医学基础上针对老年人、婴幼儿、患特殊疾病等人群,加大标准研制和产品配方研发力度,在标准化基础上创新性应用新食品原料及其他可选择成分[15,22-23],不断满足临床和市场需求。同时要继续加强法规标准等方面的体系建设,提高注册审批效率,畅通临床使用渠道并加强规范化管理,出台更具操作性的指南或细则,打击夸大虚假宣传,并加强特殊医学用途配方食品的科普宣传教育。总之,争取在各方共同努力下,大力推动我国特殊医学用途配方食品行业发展壮大,健全产品体系,不断提高配方科学性和创新性,最大程度发挥特殊医学用途配方食品临床营养支持作用,提升国民营养健康水平,助力新时代卫生健康事业发展。
参考文献
[1] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 特殊医学用途配方食品通则:GB 29922—2013[S]. 北京: 中国标准出版, 2014
[2] Codex Alimentarius Commission (CAC). The Labeling of and Claims for Foods for Special Medical Purposes: Codex Stan 180-1991[S]. 1991.
[3] 梁栋, 韩军花. 特殊医学用途配方食品—标准与管理[J]. 卫生研究, 2014, 43(3): 524-527.
[4] 中华人民共和国卫生部. 食品安全国家标准 特殊医学用途婴儿配方食品通则:GB 25596—2010[S]. 北京: 中国标准出版社, 2011.
[5] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 特殊医学用途配方食品企业良好生产规范:GB 29923—2013[S]. 北京: 中国标准出版社, 2014.
[6] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 预包装特殊膳食用食品标签:GB 13432—2013[S]. 北京: 中国标准出版社, 2015.
[7] 中华人民共和国国家卫生和计划生育委员会. 《特殊医学用途婴儿配方食品通则》(GB 25596—2010)问答[EB/OL]. (2012-02-03)[2020-11-30]. http://www.nhc.gov.cn/zwgkzt/zswdx/201201/ab61da2cdf5e466e848ec4547a579bed.shtml.
[8] 中华人民共和国国家卫生和计划生育委员会. 《特殊医学用途配方食品通则》(GB 29922—2013)问答[EB/OL]. (2015-04-15)[2020-11-30]. http://www.nhc.gov.cn/sps/s3594/201504/f91e9badc4124a3eb98b7ae3829f157e.shtml.
[9] 国家市场监督管理总局. 特殊食品信息查询平台[EB/OL]. (2020-08-01)[2021-03-05]. http://tsspxx.gsxt.gov.cn/tyyp/tyindex.xhtml.
[10] 国家药品监督管理局政务服务门户. 特殊医学用途配方食品批件发布[EB/OL]. (2020-08-01)[2021-03-05]. https://www.nmpa.gov.cn/zwfw/sdxx/sdxxtssp/tsyxpjfb/index.html.
[11] 国家市场监督管理总局食品审评中心. 特殊医学用途配方食品批件发布[EB/OL]. (2020-04-09)[2021-05-18]. http://www.cfe-samr.org.cn/sldt/sdxx/tsyxytpfsp_177/pjfb_178/.
[12] 韩军花. 中国特殊医学用途配方食品标准法规—现状及展望[J]. 营养学报, 2017, 39(6): 543-548.
[13] 国家食品药品监督管理局科技和标准司, 国家食品安全风险评估中心. 特殊食品国内外法规标准比对研究[M]. 北京: 中国医药科技出版社, 2017: 155-156.
[14] 赖鹏威, 李静, 王佳琦, 等. 国内外特殊医学用途婴儿配方食品营养成分比较研究[J]. 乳业科学与技术, 2021, 44(1): 7-12.
[15] 陈斌, 董海胜, 张国文, 等. 特殊医学用途配方食品及其应用研究[J]. 食品科学技术学报, 2017, 35(1): 6-16.
[16] 崔力航, 郭睿. 特殊医学用途婴儿配方食品营养成分调查分析[J]. 中国乳业, 2020 (6): 45-49.
[17] 索思卓, 胡豪, 王一涛. 特殊医学用途配方食品在中国的发展概况[J]. 中国食品卫生杂志, 2016, 28(2): 182-186.
[18] 张春红, 黄建, 李乘风, 等. 特殊医学用途配方食品现状及前景展望[J]. 中国食品添加剂, 2016, (12): 210-214.
[19] 李湖中, 孙大发, 屈鹏峰, 等. 国内外特殊医学用途配方食品法规标准与安全管理对比分析[J]. 中国食物与营养, 2020, 26(5): 29-34+56.
[20] 张兰天, 王晨元, 张斌, 等. 国内外特殊医学用途配方食品营养强化剂使用标准差异化分析研究进展[J]. 乳业科学与技术, 2020, 43(3): 39-44.
[21] 田洪芸, 解恒杰, 王冠群, 等. 国内外特殊医学用途配方食品标准概况及技术指标比对[J]. 中国乳品工业, 2019, 47(12): 29-33.
[22] 陈彬合, 袁振海, 贾婵媛. 我国特殊医学用途配方食品批准情况分析与开发建议[J]. 食品与药品, 2020, 22(4): 294-300.
[23] 张小庆, 张萱, 史小峰. 植物源新食品原料在特殊医学用途配方食品应用研究进展[J]. 现代食品, 2019, (20): 76-81.
素材来源网络,如侵删