肠内营养治疗是重症患者治疗的重要组成部分,然而临床实践中,由于患者个体差异性较大,不同病种及病程病人胃肠功能受损程度不同、对肠内营养的耐受性差异也很大,导致患者对于营养素的吸收各异。影响肠内营养制剂的吸收因素包括蛋白质的水解程度、渗透压、营养素配比、耐受性等。新型等渗短肽肠内营养乳剂氮源来自于蛋白质水解物,优化蛋白水解工艺,以短肽形式存在,减少氨基酸含量,更易吸收,同时降低渗透压,增加胃肠损伤患者的耐受性;优化营养素配比,优化MCT,MUFA, FUFA等脂肪组合,有效增加营养素的吸收,高效供能同时减少碳水化合物含量,降低重症患者高发的应激性高血糖风险;添加EPA、DHA成分具有一定的抗炎作用。此外,肠内营养乳剂堵管风险较混悬液更低,是临床更好吸收的短肽肠内营养制剂新选择。
撰文 | 青岛大学附属医院 重症医学科 邢金燕教授
重症患者常合并胃肠道功能障碍,严重影响对营养素的消化吸收
胃肠功能主要包括消化吸收功能、黏膜屏障功能、内分泌功能及免疫功能等,其中消化功能包括胃液、胰液、胆汁和肠液的化学性消化及胃肠运动的机械性消化作用。影响消化道吸收的主要因素是吸收表面长度、肠黏膜完整性和运动能力[1]。而临床上胃肠运动功能障碍与胃肠屏障功能障碍是危重症病人常见的主要胃肠功能障碍。危重病人胃肠运动功能障碍率高达60%,与患者不良预后相关,不仅导致营养吸收功能下降,甚至病死率显著提高[2]。
胃肠道应激后缺血再灌注损伤是重症患者胃肠损伤的病理生理过程,细胞内钙超载、氧自由基的释放等致使血管及淋巴管内皮细胞通透性增加,血浆及淋巴液外渗、回流障碍,造成组织细胞的炎性水肿,绒毛塌陷,分泌型免疫球蛋白分泌受阻,免疫屏障受损;胃肠腺体肿胀导致消化液分泌障碍,化学屏障受损。同时。肠道内环境紊乱,肠道-细菌的相互作用失衡,致病菌过度增殖使生物屏障受损;同时肠黏膜水肿导致神经细胞功能障碍,肠道动力降低。
所以针对胃肠功能损伤进行评价和针对性治疗具有重要意义。欧洲重症医学协会腹部疾病工作组(ESICM-WGAP)制定和颁布了关于危重症患者急性胃肠功能损伤(AGI)分级诊疗推荐意见,建议对危重症患者进行AGI分级诊疗[3]。
胃肠功能障碍发病机制复杂,诱因较多,早期有效预防及治疗是最关键的措施。早期、合理的肠内营养可为肠黏膜提供足够的能量,促进肠道功能康复。大量研究及权威指南均推荐重症患者应早期(进入ICU后24-48小时内)启动营养治疗。《重症病人胃肠功能障碍肠内营养专家共识》(2021版)推荐AGI Ⅰ~Ⅲ级病人可从最低剂量开始肠内营养,建议根据AGI严重程度分级指导营养支持策略。
重症患者早期肠内营养可选择短肽类制剂,不增加消化负担,容易吸收
研究发现,人体胃肠道的摄取系统具有特异性,更适合吸收4~12个氨基酸的短肽[4]。短肽型肠内营养(EN)制剂含有寡肽、寡糖和中链甘油三酯(MCT),吸收快,粪便产生少,适用范围广泛[4],还能通过改善氮留存/氮平衡、胃肠耐受性、降低细菌移位风险、维持/修复肠道完整性等多种作用机制带来肠道获益,故被多个国内外指南推荐。
中华医学会发布的《重症患者早期肠内营养临床实践专家共识》[5]明确指出:预消化的短肽型EN制剂有助于改善喂养不耐受现象,有利于启动早期肠内营养(EEN);对于持续性腹泻、可疑吸收不良、肠缺血或纤维耐受不佳的患者,建议使用短肽型EN制剂;对于重症患者,选择短肽肠内营养制剂,可以有效营养胃肠黏膜,增强神经内分泌功能,有利于保留肠道黏膜屏障功能和免疫功能,改善胃肠功能损伤。美国肠外肠内营养学会(ASPEN)和美国重症学会(SCCM)发布的《重症营养指南》[6]亦提到,在持续性腹泻、怀疑吸收不良,对纤维无反应的持续性腹泻患者使用短肽配方制剂;提高中度至重度急性胰腺炎患者对肠内营养的耐受性的措施,包括从标准整蛋白制剂转化为含有短肽和中链甘油三酯的制剂等。
优化的营养素配比更易吸收
营养素配比是营养素吸收率的一个重要因素。曾有研究表明高脂肪摄入可抑制蛋白质和碳水化合物的吸收。一项动物研究比较了三种短肽制剂(Peptisorb,Salvipeptid,Survimed)在小型猪体内的吸收。结果显示短肽肠内营养乳剂Survimed的吸收率最高[7]。作者分析原因为与其他两种制剂相比,其脂肪含量、碳水化合物含量适中(碳水,蛋白,脂肪供能比:60:18:22)。
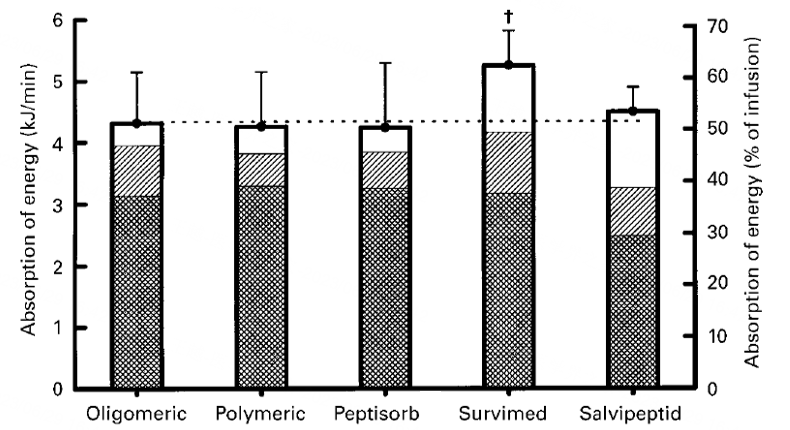
图1 小型猪体内研究显示Survimed吸收率最高
优化蛋白水解工艺,减少游离氨基酸含量更易吸收
重症患者应激状态下皮质醇和肾上腺素等分泌增加,胰岛素分泌减少,体内肌肉蛋白分解增加为糖异生提供原料。尿氮的排出量相应增加,机体处于负氮平衡状态。所以增加蛋白质的补充,可使重症患者获益。首先,增加蛋白/氨基酸补充可帮助机体抵消机体蛋白分解,维持肌肉质量,改善营养状态,从而改善患者预后。同时有研究表明,推荐剂量的蛋白质补充可显著改善重症患者的生存率。然而氨基酸肠内营养制剂纯尿素生成过多,氮留存率差,且口味不佳,高渗透压,容易导致呕吐、腹泻、电解质异常、细菌移位,限制了其获益[4]。二肽和三肽的特点是消化和吸收速度比游离氨基酸更快,因此,在选择肠内营养制剂时,掌握水解产物中肽链的长度有重要的临床意义[4]。
新型等渗短肽肠内营养乳剂优化了蛋白水解工艺,减少游离氨基酸含量,渗透压更低;并通过创新性工艺改善了口感和味道,提升患者依从性,更有利于患者有效吸收多种营养素。
渗透压是影响吸收的重要方面,等渗更易吸收
既往研究显示,溶液渗透压影响胃肠水量,影响肠道药物吸收[8]。研究显示,高渗环境降低药物吸收、渗透压越高,吸收率越低[9]。等渗溶液维生素B族的吸收率最高[10]。另有研究显示,在溃疡性结肠炎的小鼠中,与400和500 mosm/L的肠内营养制剂比较,300 mosm/L的肠内营养制剂生存状态最好,DAI(疾病活动指数)降低最明显,肠道屏障功能改善最好,结肠组织改善最明显等诸多优势。
恰当渗透压,降低腹泻发生,保证肠内营养的吸收
大于50%的ICU病人存在喂养不耐受,其中腹泻是最常见原因。大部分情况下,渗透压越高,肠道不耐受性发生率越高,超过400 mosm/L的营养液可引起渗透性腹泻[11]。腹泻不可避免的会引起吸收率下降,无法按照原计划达到目标喂养量和营养治疗目的[12]。对于胃肠功能受损患者,选择等渗的短肽肠内营养制剂可预防渗透性腹泻,增加耐受性,减少腹泻,使得营养物质更有效的吸收[10, 13]。
新型等渗短肽制剂蛋白质的水解程度更优、渗透压低、营养配比优化、耐受性佳。
1,一项多中心、前瞻性研究(DIAPOENO)显示:因肿瘤治疗导致相关腹泻且存在营养风险的肿瘤患者经等渗短肽肠内营养乳剂治疗8周,48.3%的患者营养状态改善,中、重度营养不良分别减少19.9%和7.3%(P<0.001),血清白蛋白和体重指数(BMI)显著改善(P<0.005),71.1%的患者腹泻症状改善,平均排便次数显著降低(4.17 vs 1.42次/天,P=0.0041)。患者生活质量(包括精力、疼痛、情绪反应、睡眠、社交、运动等方面,P均<0.05)显著改善[14]。
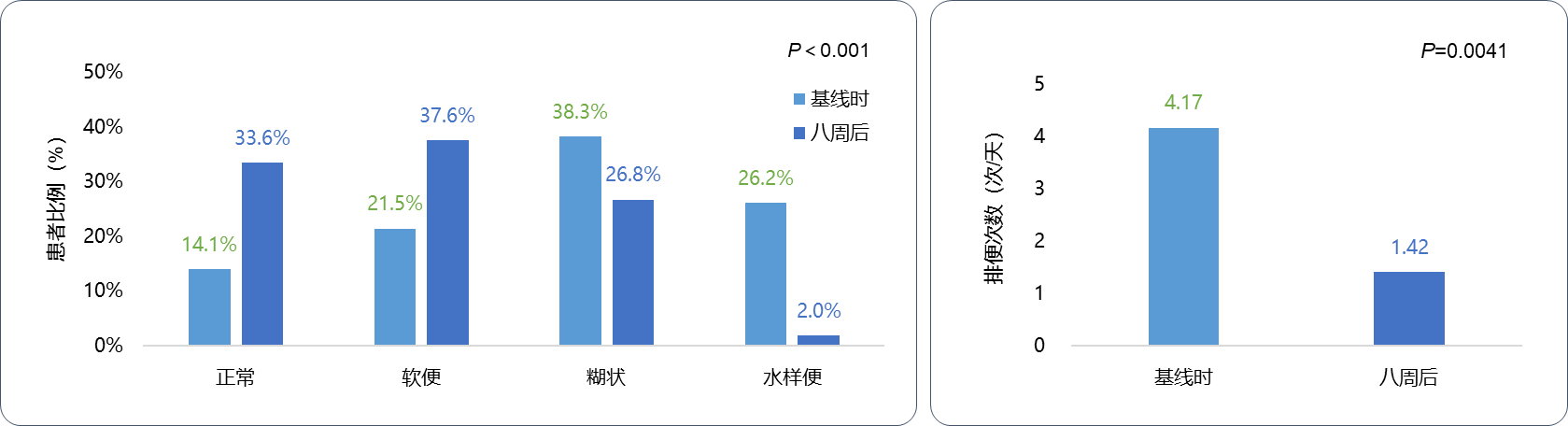
图2 新型短肽制剂显著改善肿瘤治疗相关腹泻患者的粪便性状、排便次数
2,一项针对144例活动性克罗恩病患者的前瞻性研究显示,给予肠内营养乳剂等渗短肽肠内营养乳剂12周后营养状况改善:营养不良低危患者提高到76.1%,平均白蛋白水平和体重指数(BMI)有所改善(分别从3.0g/dl改善至3.7g/dl和从20.2kg/m2改善至21.1kg/m2)。Harvey Bradshaw指数(HBI,评判疾病严重程度)显著下降(从10.2降至3.7)。每日平均排便次数减少(从4.6次/天减少至1.7次/天)[15]。
3,两项针对急性胰腺炎患者的研究显示,相比肠外营养,早期给予等渗短肽肠内营养乳剂可减少脓毒症并发症的发生率,降低重症感染发生率、死亡率[16]。在血流动力学不稳定患者中也观察到良好的耐受性[17]。
此外,等渗短肽肠内营养乳剂碳水化合物含量优化,占总能量来源的57%,较传统短肽制剂碳水含量低,可以减少胰岛素的分泌需求,降低胰岛素抵抗,从而减少血糖的升高。其碳水化合物供能比符合国内外相关指南的推荐,对于应激性高血糖的重症患者有重大意义。等渗短肽肠内营养乳剂含有51%(占总脂肪的比例)中链甘油三酸酯(MCT)。可快速被小肠吸收,改善胃肠功能受损的重症患者的耐受性[10]。此外,等渗短肽肠内营养乳剂还优化了其他成分的脂肪组合,含有21% (占总脂肪的比例)多不饱和脂肪酸(MUFA)和22%(占总脂肪的比例)单不饱和脂肪酸(PUFA)。同时添加了EPA、DHA成分具有一定的抗炎作用。关于剂型,相较于混悬液,乳剂中含有乳化剂和稳定剂等成分,可以使油质和水质相互不溶的两种液体混合,不易分层或沉淀,堵管风险较低,患者依从性更高。
小结
胃肠功能损伤患者由于胃肠动力,胃肠屏障以及消化吸收障碍等因素易出现营养不良的现象。营养不良会导致患者的病情进一步加重,因此需要给予患者合理的营养支持,目前临床上主要采取早期肠内营养支持的方法来改善患者的营养状态。相较于传统短肽肠内营养制剂,等渗短肽肠内营养制剂具有营养素配比合理、水解蛋白易吸收、渗透压合理、耐受性良好、碳水化合物比例优化、脂肪组合MCT,MUFA,PUFA优化、剂型适宜等优势,可有效改善重症患者营养状况、降低并发症发生率及病死率,更适用用于胃肠功能损伤患者。
素材来源网络,如侵删